Balancetermisk er den tilstand, hvor et legeme befinder sig i sammetemperatur end deres omgivelser. Det observeres, at alle kroppe, der har højere temperaturer end deres naboer, har tendens til at give dem varme spontant, indtil begge begynder at præsentere den samme temperatur.
Seogså:Grundlæggende om termologi
Termisk ligevægt og termodynamikens nul lov
Termisk ligevægt er det centrale koncept bag termodynamikens nul lov. En sådan lov fastslår, at i det tilfælde, hvor to termodynamiske systemer DET og B, er i termisk ligevægt med et tredje termodynamisk system, Ç, derefter, DET og B de vil også være i termisk ligevægt.
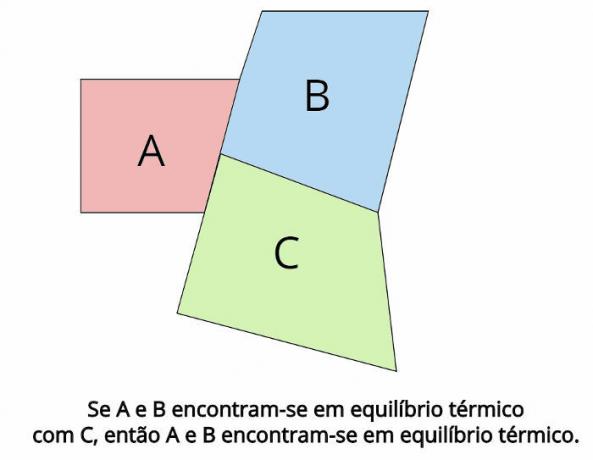
I termisk ligevægt skal de endelige temperaturer for hvert legeme være ens: TDET = TB = TÇ
Tjek hvad udsagnet om termodynamikens nul lov fastlægger:
“Hvis to kroppe er i termisk ligevægt med et tredje legeme, så vil disse kroppe være i termisk ligevægt med hinanden. ”
En anden måde at forstå termisk balance er baseret på kroppens indre energi. Intern energi eller simpelthen termisk energi er en fysisk størrelse
direkteproportional à temperatur af kroppen. Derfor, hvis der er kroppe med forskellige temperaturer inden for det samme termodynamiske system, vil de have forskellige moduler af intern energi og vil derfor overføre noget af den energi mellem dem, indtil der ikke er nogen forskel mellem deres energier. indre. Vil du vide mere om, hvad intern energi er, og hvad dens egenskaber er? Få adgang til artiklen: Intern energi.Stop ikke nu... Der er mere efter reklamen;)
varme- og termisk balance
Varmeoverførsel sker altid spontant fra kroppen med den højeste temperatur til kroppen med den laveste temperatur. Denne overførsel af energi i form af varme kan ske gennem processer som f.eks kørsel, konvektion og stråling.
Kørsel: Det er overførslen af varme mellem legemer, der især forekommer i faste stoffer. I denne ledningstype forekommer der ingen masseoverførsler. Denne type varmeoverførsel forklarer, hvordan termisk ligevægt forekommer i f.eks. Metaller.
Konvektion: Det er en varmeoverførsel, der finder sted i væsker. I denne tilstand af varmeoverførsel er der masseoverførsel, når den opvarmede væske bevæger sig og danner konvektionsstrømme, indtil al væsken når termisk ligevægt.
Stråling: Det er transmission af varme gennem elektromagnetiske bølger, så denne proces sker, selvom der ikke er noget fysisk medium mellem kroppen og en anden krop ved forskellige temperaturer. Varmen, der overføres, svarer i dette tilfælde til elektromagnetiske bølger med mindre energi end synligt lys, således at det er termisk stråling, der ligger i regionen infrarød.
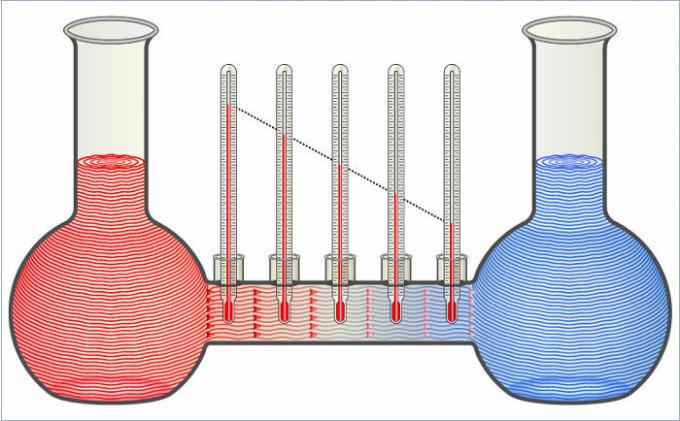
De to væsker i figuren overfører varme til hinanden, indtil deres temperaturer er ens.
Ønsker du at vide mere om, hvordan hver af varmeoverførselsprocesserne finder sted? Få adgang til artiklen: Varmeudbredelsesprocesser.
fornuftig varme
når der er forskelitemperatur mellem to kroppe eller mellem et legeme og dets omgivelser, vil der spontant være varmeudveksling mellem dem, så krop med højere temperatur køler ned, og krop med lavere temperatur opvarmes, indtil de alle når temperaturen i balancetermisk.
Den mængde varme, der udveksles mellem kroppe ved forskellige temperaturer kaldes fornuftig varme og dette beløb kan beregnes ud fra formlen vist i nedenstående figur:
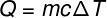
Q - varme (kalk eller J)
m - masse (g eller kg)
ç - specifik varme (cal / gºC eller J / kg. K)
AT - temperaturvariation (° C eller K)
I formlen vist ovenfor er det vigtigt at fremhæve navnets storhed specifik varme. en sådan størrelse måler mængde energi pr. masse, som et stof har brug for at give eller absorbere, for at temperaturen varierer med 1 ° C. I tilfælde af f.eks. Rent vand og under normale trykforhold for at variere temperaturen med 1 ° C er der brug for 1,0 kalorie for hvert gram vand.
Således har alle stoffer, der har etableret termisk kontakt med hinanden, en tendens til at nå tilstanden af balancetermisk over tid spontant kræver nogle imidlertid en større mængde energi for at gøre det, og dette påvirker direkte temperaturen for at nå termisk ligevægt.
Læsogså:Hvad er temperatur?
latent varme
Det er muligt, at under kropsudveksling med omgivelserne præsenterer et tryk, temperatur og volumen, der får det til at gennemgå en ændring i sin fysiske tilstand. Disse ændringer forekommer i temperaturkonstant (for legemer sammensat af et enkelt stof uden urenheder), dvs. på trods af at de modtager eller giver varme til det ydre miljø, ændres temperaturen i disse kroppe ikke.
Dette er kun muligt, fordi al den udvekslede energi, i dette tilfælde, bruges til at ændre konformationen af dine molekyler. Fra det øjeblik energibarrieren er "overvundet", og hele kroppens indhold er i en anden fysisk tilstand, den Kroppen fortsætter med at udveksle varme med sine omgivelser, medmindre naturligvis temperaturen er lig med temperaturen udenfor.
O latent varme kan beregnes ud fra formlen vist i nedenstående figur, tjek den ud:
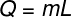
Q - latent varme (kalk eller J)
m - masse (g eller kg)
L - specifik latent varme (cal / g eller J / kg)
Termisk ligevægtsformel
Hvis vi vil finde ud af, hvad der er temperaturibalance af et eller andet termodynamisk system er det nødvendigt, at vi betragter det pågældende system som et systemisoleret, det vil sige, vi må antage, at der ikke udveksles nogen mængde varme med kvartererne i dette system.
Fra denne tilstand kan vi sige, at hele den mængde varme, der udveksles, kun udveksles mellem de organer, der udgør dette system, bortset fra varmetab f.eks. til beholderens vægge. I dette tilfælde siger vi, at containeren har termisk kapacitet ubetydelig, dvs. det absorberer ikke nogen varme.
Forestil dig følgende situation: i en kop varm te, med ubetydelig varmekapacitet, hæld nogle isterninger. For at bestemme den termiske ligevægtstemperatur skal vi ud over at kende systemets indledende forhold overveje nogle overvejelser:
Al den mængde varme, som den varme te giver til isen, absorberes fuldt ud af den, da koppen har ubetydelig varmekapacitet.
Vi skal se bort fra varmetab til luften og andre omgivelser, så denne kop te kan forstås som et lukket termodynamisk system.
På denne måde kan vi fastslå, at hele mængden af varme, der modtages af isen, blev opgivet af den varme te, med det skrev vi vores formel til beregning af den termiske balance:
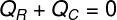
QR - Modtaget varme
QÇ - varme indgivet
Varmen indgivet (QÇ), henviser til den mængde varme, som den varme te overførte til de isterninger, der er indsat i den. Allerede den modtagne varme (QR) er den mængde varme, disse isterninger modtog. Denne mængde varme har to naturer: varme følsom og varmt latent, da isterningerne sandsynligvis smelter for at komme i termisk ligevægt.
Bestemmelse af den termiske ligevægtstemperatur
Lad os bestemme den termiske ligevægtstemperatur ud fra følgende situation:
En kop med ubetydelig termisk kapacitet, der indeholder 200 ml (200 g) te ved en indledende temperatur på 70 ° C, modtager 10 g is ved en temperatur på -10 ° C. Bestem systemets termiske ligevægtstemperatur (antag, at den specifikke varme af te er lig med den specifikke varme af vand):
Data:
çVAND = 1,0 cal / g ° C
çIS = 0,5 cal / g ° C
LIS = 80 cal / g
For det første mener vi, at al varmen, der modtages af isen, blev givet væk af teen:

Dernæst er det nødvendigt at specificere, hvilke former for varme der blev givet og modtaget:
Te: Te gav kun fornuftig varme (Qs), da hans fysiske tilstand ikke er ændret.
Is: Isen var oprindeligt ved -10 ° C, så den modtog fornuftig varme (Qs) indtil en temperatur på 0 ºC, derefter modtaget latent varme (QL) at flyde. Efter at være blevet flydende modtog den latent varme (Qs) indtil den kommer ind i termisk ligevægt (TF) med te.
Når vi oversætter det, der blev analyseret ovenfor i form af en ligning, har vi følgende beregning at løse:
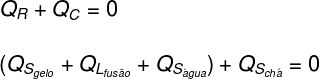
Ved at erstatte dataene fra øvelsen i ovenstående ligning bliver vi nødt til at løse følgende beregning:
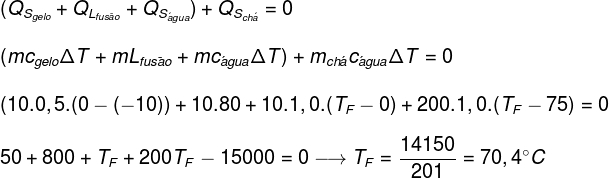
Ifølge beregningen foretaget ovenfor skal ligevægtstemperaturen for te + is-systemet være ca. 70,4 ° C.
Forsøg med termisk balance
For at teste den termiske balance mellem to kroppe kan vi udføre flere eksperimenter. Den enkleste af disse involverer dog brugen af en kalorimeter det er en termometer. Kalorimeteret er en adiabatisk beholder (som ikke tillader varmepassage) med termisk kapacitet omubetydelig, som en gryde foret med styrofoam, for eksempel, som er en god varmeisolator.

Kalorimeteret bruges til at måle temperaturvariationen i systemet indeni.
Termisk balance og liv på jorden
O balancetermisk det spiller en grundlæggende rolle i det jordiske liv. Uden tilstedeværelsen af drivhusgasser i Jordens atmosfære er det meste af det termisk stråling af planeten ville forlade det og udbrede sig i rummet. Over tid vil dette medføre massiv afkøling over hele planeten, hvilket får havene til at fryse over tid.
Derudover spiller havene en nøglerolle i balancetermisk af planeten. I kraft af dets store pasta og varmebestemt, havene er udstyret med et enormt kapacitettermisk, det vil sige, at de har brug for at modtage enorme mængder varme for at ændre deres temperatur. Af denne grund er de i stand til at regulere planetens temperatur meget effektivt. Regioner langt fra havene og med lidt vand er normalt store termiske områdersom i ørkener, der er ekstremt varme om dagen og fryser om natten.
Derfor er den balancetermisk det er en proces af grundlæggende betydning for vedligeholdelsen af planetens fysiske, kemiske og biologiske processer og derfor essentiel for eksistensen af liv på jorden.
Af mig Rafael Helerbrock


