DET elektronegativitet det er et atoms tendens til at tiltrække elektroner mod sig selv, når det er knyttet til et andet kemisk element. gennem en kovalent binding, dvs. hvor der er deling af elektroner, idet dette molekyle betragtes som værende isoleret.
Lad os overveje to eksempler for bedre at forstå det præsenterede koncept:
1. eksempel: Brintgasmolekyle: H2 → H - H
Når to brintatomer kommer sammen, forekommer tiltrækningskræfter mellem kernen i hver på samme tid. et af disse atomer med elektronet fra det andet atom og frastødningskræfter mellem elektronerne og kernerne i de to atomer. Når disse kræfter når ligevægt, er de to elektroner i et område af elektrokuglerne, der er et sted mellem de to. atomer i molekylet, hvor begge interagerer med de to elektroner og bliver stabile, dvs. de to atomer deler et par elektroner.

Dette er en kovalent binding, der danner et molekyle. Men da de to atomer i dette molekyle er nøjagtigt de samme, er den måde, hvorpå de tiltrækker elektroner til hinanden, også den samme. Så vi siger det
der er ingen forskel i elektronegativitet eller at hun det er apolar.2. eksempel: Hydrogenchloridmolekyle: HC2
I dette tilfælde udføres delingen af et elektronpar mellem forskellige elementer, fordi i denne forbindelse kloratomet tiltrækker elektroner med større intensitet end brint. Derfor siger vi, at klor er mere elektronegativ end brint.
Som vist i figuren nedenfor a. På grund af forskellen i elektronegativitet elektrisk dipol (μ), som er to elektriske monopoler, hvor elektroner har en tendens til at være mere tiltrukket af klor. Så bindingen H ─ Cℓ vil have en delvis negativ ladning på klor (δ-og en delvis positiv ladning på hydrogen (δ+). Så dette er et molekyle med elektronegativitetsforskel og er polar:

Dette viser os, at elektronegativitet er en relativ størrelse, ikke en absolut størrelse, da den bestemmes ved at tage hensyn til sammenligninger af kræfter, der udøves af atomer i en kovalent binding.
Der er flere måder at beregne elektronegativitet på, men den mest almindelige er elektronegativitetsskalaen foreslået af Pauling. Lad os sige, at vi har et generisk molekyle A - B. Pauling foreslog, at bindingsenergien i dette molekyle, symboliseret ved D, ville blive givet ved summen af det aritmetiske gennemsnit af bindingsenergierne (D) af gasmolekylerne i disse to atomer, det vil sige A-A og B-B, med kvadratet af forskellen i elektronegativiteter for hvert atom i det molekyle (xDET og xB):
Stop ikke nu... Der er mere efter reklamen;)
D(A-B) = [D(A-A) + D(B-B)] + k (xDET - xB)2
Konstanten k i formlen ovenfor er lig med 96,5 kJ. mol-1. Pauling tildelte en vilkårlig værdi for elektronegativiteten for brint, som var 2,1, og på denne måde var det muligt at opdage elektronegativitetsværdien af de andre elementer i forhold til han.
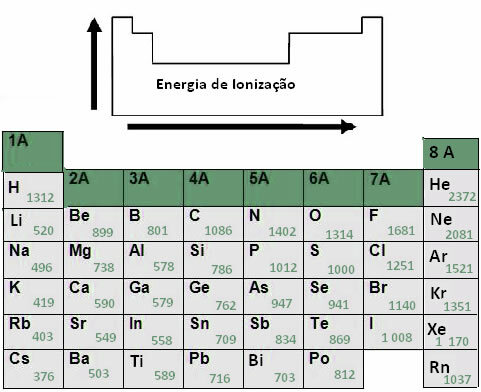
Baseret på denne metode blev Paulings elektronegativitetsværdier givet for elementerne i det periodiske system med undtagelse af ædelgasser.

Bemærk, at disse værdier er en periodisk egenskab, da de varierer periodisk baseret på elementernes atomnummer. Se for eksempel, at de mest elektronegative elementer er dem i øverste højre hjørne af tabellen, det vil sige fluor (4.0) og ilt (3.5), og den mindst elektronegative er dem i nederste venstre hjørne, som er francium (0,8) og cæsium (0,8).
Baseret på dette blev det endda oprettet en række elektronegativitet af de mest elektronegative elementer, der har tendens til at blive bearbejdet mest:
F> O> N> Cℓ> Br> I> S> C> P> H
Se elektronegativitetsværdierne:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Der er et slags "trick" til at dekorere denne række elektronegativitet, som er givet ved nedenstående sætning, hvor initialen for hvert ord svarer til symbolet på de pågældende elementer:
“FHej Ohar ikke NO Clube, brjeg har jegsav Çdøende Ptil HHospital"
Så vi kan sige det elektronegativitet er en periodisk egenskab, der stiger fra venstre til højre og nederst til toppen på det periodiske system.

Dette er på grund af atomradiusens størrelse. Jo større radius for et atom er, jo længere væk er de delte elektroner fra dets kerne, og jo svagere er tiltrækningen mellem dem. Det modsatte er også sandt, jo mindre atomradius, jo tættere er elektronerne på kernen og jo større tiltrækningskraft mellem dem. Således kan vi konkludere følgende:
Elektronegativitet stiger med faldende atomradius.
Af Jennifer Fogaça
Uddannet i kemi