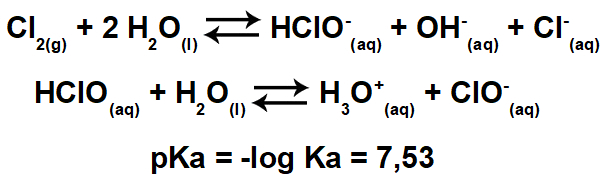Når vi siger ordet "balance", kommer et objekt, der forbliver på ubestemt tid, i tankerne. Dette er dog kun en slags balance, kaldet “Statisk ligevægt”.
Der er også “Dynamisk ligevægt”. Der er, som navnet siger, ikke et eneste øjeblik, hvor det pågældende objekt eller fænomen stadig er. For eksempel for at forstå det, se illustrationen nedenfor og bemærk, at mængden af vand, der falder i beholderen, er lig med den mængde, der strømmer ud af den, og holder vandstanden konstant. I så fald siger vi, at der er en dynamisk balance, en balance i bevægelse.

Det er denne form for balance, der opstår i reversible reaktioner, det vil sige i de reaktioner, der forekommer i begge retninger. På samme tid, som molekylerne i reaktanterne omdannes til produkterne, reagerer produktets molekyler med hinanden for at danne reaktanterne. Reversibiliteten af en reaktion er repræsenteret af pile i begge retninger:
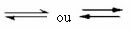
I det øjeblik, hvor udviklingshastigheden for den direkte reaktion (dannelse af produkterne) er lig med udviklingshastigheden for invers reaktion (dannelse af reaktanter) under konstant temperatur betyder, at reaktionen har nået sin ligevægt kemisk. Og i tilfælde af reaktioner med tilstedeværelsen af kun molekyler i reaktanterne og produkterne har vi en molekylær balance.
Stop ikke nu... Der er mere efter reklamen;)
Det følgende er et eksempel på den reaktion, der finder sted mellem hydrogengas (H.2) og jodgas (I2) til dannelse af brintiodid (HI) gas:
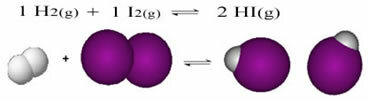
I begyndelsen af reaktionen var udviklingshastigheden for den direkte reaktion højere, når alt sammen koncentrationen af reaktanter var maksimal, og koncentrationen af produkterne var nul. Så udviklingshastigheden for den omvendte reaktion var også nul.
Imidlertid reagerer brint- og iodgasserne over tid og genererer produktet. På denne måde begynder koncentrationen af reagenser at falde, og deres udviklingshastighed falder også.
Når koncentrationen af produkter stiger, og koncentrationen af reaktanter falder, begynder udviklingshastigheden for den omvendte reaktion at stige. Hvis temperaturen holdes konstant, vil der komme et tidspunkt, hvor de to udviklingshastigheder forbliver de samme, hvilket viser, at reaktionen har nået kemisk molekylær ligevægt.
Af Jennifer Fogaça
Uddannet i kemi
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Molekylær balance"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm. Adgang til 28. juni 2021.