
Nogle gange kan det ske med minimumsformel være den samme som molekylformlen for forbindelsen; dette er dog ikke altid sandt.
For eksempel er den empiriske eller minimale formel for vand H2O, hvilket indikerer, at der er et forhold på 2: 1 mellem de grundstoffer, der udgør vandmolekyler. Og tilfældigvis er dette også molekylformlen for vand. For at se, at dette ikke altid sker, skal du se på følgende to eksempler:
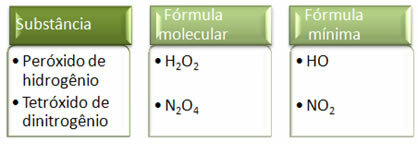
Da minimumsformlen kun er forholdet mellem hvert grundstofs atomer og ikke den faktiske mængde af dem i molekylformlen, kan det forekomme af forskellige forbindelser med den samme empiriske formel og endog minimumsformlen for en forbindelse kan være den samme som molekylformlen Andet. Bemærk, i eksemplet nedenfor, hvordan dette kan ske:
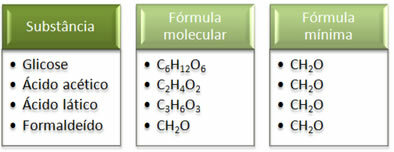
Se at minimumsformlen CH2Det er det samme for alle stoffer, det vil sige, denne minimale formel udtrykker, at i alle tilfælde carbon-, hydrogen- og iltatomer er til stede i molekylformler i et forhold på 1:2:1. Desuden er den eneste, der har den samme molekylformel som den empiriske formel, formaldehyd.
- Beregning af den minimale eller empiriske formel:
For at bestemme den empiriske formel for en forbindelse er det først nødvendigt at vide, hvad dens procentdel eller nærmeste formel er. Dette kan gøres ved at måle massen af hvert element i 100 g af en prøve. Teksten "Procentdel eller centesimal formel”Præciserer denne sag bedre.
Stop ikke nu... Der er mere efter reklamen;)
Lad os for eksempel sige, at den nærmeste sammensætning af en given forbindelse er givet ved: 40,00% C, 6,67% H og 53,33% O. Vi overfører disse værdier til gram under hensyntagen til en masse på 100 g kompostprøve. Således har vi: 40 g C, 6,67 g H og 53,33 g O.
Nu er det nødvendigt at overføre disse værdier til mængden af stof (mol). Vi gør dette ved at dividere hver af de værdier, der findes med deres respektive molære masser:
C: 40/12 = 3,33
H: 6,67 / 1 = 6,67
O: 53,33 / 16 = 3,33
Da værdierne ikke er heltal, bruger vi følgende enhed: Vi deler alle værdier med de mindste af dem, så proportionen mellem dem ikke ændres.
I dette tilfælde er den mindste værdi 3,33, så resultatet bliver:
C: 3,33 / 3,33 = 1
H: 6,67 / 3,33 = 2
O: 3,33 / 3,33 = 1
Således er minimumsformlen for dette ukendte stof lig med: Ç1H2O1 eller CH2O.
Kort fortalt er de nødvendige trin for at finde et stofs empiriske eller minimale formel:

Af Jennifer Fogaça
Uddannet i kemi
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Minimum eller empirisk formel"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm. Adgang til 28. juni 2021.



