DET Loven om reaktionshastighed relaterer hastigheden af en kemisk transformation med koncentrationerne af reagenser i mængden af stof (mol / L), som kan angives som følger:

Overvej f.eks. Følgende generiske reaktion:
aA + bB → cC + dD
Lad os sige, at vi øger koncentrationen af reaktanterne A og B, hvad sker der med reaktionshastigheden? Da mængden af reaktantpartikler vil stige i samme rum, vil der være mere effektive kollisioner mellem dem, hvilket vil resultere i en stigning i hastigheden for reaktionsudvikling. Hvilket betyder, at det vil øge din hastighed.
Derfor er reaktionshastigheden direkte proportional med koncentrationen af reaktanterne. Det afhænger dog også af temperaturen. Derfor har vi følgende matematiske ligning, der repræsenterer loven om reaktionshastighed:

På hvilke:
v = reaktionshastighed;
k = konstant, der kun afhænger af temperaturværdien;
α og β = eksponenter bestemt eksperimentelt.
Kun når reaktionen er elementær, dvs. den sker i et enkelt trin, er eksponenterne nøjagtigt lig med koefficienterne for den afbalancerede kemiske ligning:
v = k. [DET]Det. [B]B. I andre tilfælde skal den passende styrke, hvortil koncentrationen af hvert reagens skal hæves, imidlertid bestemmes eksperimentelt.Stop ikke nu... Der er mere efter reklamen;)
Loven om reaktionshastighed går under mange navne, her er nogle: Lov om masseaktion, ligning af hurtighed, kinetisk reaktionslov og Guldberg-Waage-lov.
Overvej et eksempel på, hvordan denne lov anvendes:
Overvej følgende elementære reaktion:
2 HCI (g) → H2 (g) + Cl2 (g)
a) Skriv ligningen for hastigheden af denne reaktion;
b) Gennem eksperimenter blev hastigheden af denne hydrogenchlorid-nedbrydningsreaktion og koncentrationen af dette reagens ved en konstant temperatur på 25 ° C noteret i nedenstående tabel:
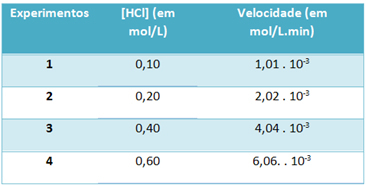
På baggrund af dette skal du bestemme den karakteristiske hastighedskonstant for denne reaktion ved den nævnte temperatur.
Løsning:
Det) v = k. [HCI]2
b) v = k. [HCI]2
k = __v___
[HCI]2
k = 1,01. 10-3 mol. L-1. min-1
0,01 mol. L-1
k = 1,01. 10-1 min-1
For at løse bogstavet “b” kan du bruge dataene fra ethvert af eksperimenterne, at den opnåede værdi vil være den samme.
Men hvad nu hvis reaktionen ikke er elementær? Hvordan vil det være muligt at løse spørgsmål som disse i ikke-elementære reaktioner? For at finde ud af hvordan, skal du læse hastighedsloven for ikke-elementære reaktioner.
Af Jennifer Fogaça
Uddannet i kemi
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Lov om hastigheden af kemiske reaktioner"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm. Adgang til 27. juni 2021.