For at du kan forstå fænomenet ionisering det er først nødvendigt at vide, hvad ioner er. Bemærk forklaringen nedenfor:
Hvert atom har det samme antal protoner og elektroner; derfor er hvert atom elektrisk neutralt. Endvidere har stoffer dannet af grupper af atomer også en elektrisk ladningsbalance, der er elektrisk neutral.
Imidlertid, et atom eller en gruppe af atomer kan miste eller vinde elektroner; når det sker, mister de neutralitet og bliver ioner.
Hvis atomet eller gruppen af atomer mister elektroner, vil det være positivt ladet og kaldes en ion kation. Men hvis du får elektroner, vil opladningen være negativ, og ionen vil være en anion.
Uorganiske stoffer er ioniske eller har evnen til at danne ioner.
En af måderne til dannelse af ioner er ved at placere molekylære stoffer i vand, dvs. dannet af kovalente bindinger, hvor elektroner deles.
For eksempel, hvis vi tester den elektriske ledning af saltsyre (HCI) i vandig opløsning (hydrogenchlorid opløst i vand), vil vi se, at opløsningen er elektrolytisk, det vil sige, at den leder en elektrisk strøm, fordi der er ioner i dette opløsning.

Dette betyder, at vand fungerede som en reaktant og dannede ioner fra saltsyre. Dette sker ifølge nedenstående reaktion:
Stop ikke nu... Der er mere efter reklamen;)
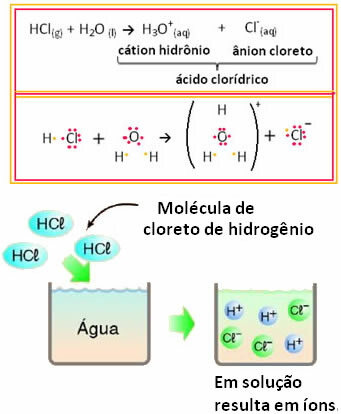
Bemærk, at der ikke var ioner, før der blev bragt hydrogenchlorid i vand. Imidlertid reagerede dets molekyler med vand og dannede positive H-ioner3O+ (kationer) og negativer Cl- (anioner). Da klor er mere elektronegativ end brint, tiltrækker det paret elektroner fra den kovalente binding tæt på det og danner anionen. Brint tiltrækkes derimod af ilt i vand, som er mere elektronegativt end klor; og mellem hydrogen og ilt dannes en kovalent binding, der giver anledning til hydroniumkationen. Dette fænomen med iondannelse kaldesionisering.
Baseret på ovenstående forklaring kan vi definere ionisering som følger:

Bemærk, at ionerne ikke eksisterede før, for hvis de eksisterede, som i tilfælde af opløsning af ioniske forbindelser, ville vi have en ionisk dissociation og ikke en ionisering.
Alle syrer, der er i kontakt med vand, gennemgår ionisering. Imidlertid gennemgår ikke alle molekylære forbindelser ionisering.For eksempel sukker (C12H22O11) er molekylær, men når den anbringes i vand, dannes der ikke ioner, den opløses bare og stammer fra en ikke-elektrolytisk molekylær opløsning, som ikke leder elektricitet.
Af Jennifer Fogaça
Uddannet i kemi
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Ionisering"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/ionizacao.htm. Adgang til 28. juni 2021.



