Du Kulbrinter er sammensat dannet af kulstof (C) og hydrogen (H). Fleksibiliteten af kulstof, som er hovedelementet i disse forbindelser, favoriserer eksistensen af en enorm mangfoldighed af strukturer Derfor kan nogle egenskaber, såsom smeltepunkt og kogepunkt, variere mellem et carbonhydrid og et andet.
De er for det meste molekyler apolar, med styrkes intermolekylær induceret dipoltype og tæthed mindre end Det fra vand. Identifikationen af disse forbindelser kan ske gennem nomenklaturen, der følger reglerne oprettet af International Union of Pure and Applied Chemistry (Iupac).
Læs også: Kulstof - et af de mest rigelige elementer i universet
Egenskaber for kulbrinter

Polaritet: carbonhydrider uden tilstedeværelse af heteroatomer er apolar.
Intermolekylære kræfter: bindingerne mellem molekylerne i et carbonhydrid er af typen induceret dipol.
smeltepunkt og ogkogende: de varierer alt efter molekylets størrelse, funktion og strukturelle organisation.
fysisk tilstand: under normale temperatur- og trykforhold er carbonhydrider med fire eller færre carbonatomer i gasform. Dem med 5 til 17 carbonatomer er i flydende tilstand, og carbonhydrider med mere end 17 carbonatomer er faste stoffer.
Massefylde: er mindre end massefylde vand, dvs. mindre end 1,0 g / cm3.
Reaktivitet: alifatiske og umættede kulbrinter er dårligt reaktive; umættede forbindelser er mere tilbøjelige til at reagere med andre molekyler, og cykliske carbonhydrider med op til fem carbonatomer er meget reaktive.
Klassificering af kulbrinter
Kulbrinterne kan klassificeres efter den strukturelle organisation af kæden og af virksomhederne.Umættethed er tilstedeværelsen af dobbelt (er) eller tredobbelt binding mellem carbonatomer, er forekomsten af pi-type forbindelser (π). allerede den grene de er som "grene" fastgjort til en større kulbrintestruktur. Cykliske kæder kan også indeholde grene og / eller umættetheder - den strukturelle organisering af lukkede carbonhydrider danner polygoner såsom kvadrat, trekant, hexan, blandt andre.
Med hensyn til arrangementet af atomer kan et carbonhydrid have en normal eller forgrenet kæde.
→ C-carbonhydridnormal, lineær eller lige linje: den ene med en streng, der kun har to ender.

→ C-carbonhydridhader forgrenet: den med en kæde, der har mere end to ender. For at vide, hvor og hvad grenene er, er det vigtigt at vælge hovedkæden korrekt. Hovedkæden skal indeholde alle umættetheder og heteroatomer (hvis nogen), såvel som det største antal sekventielle kulhydrater. Kulstoffer, der ikke er indeholdt i hovedkæden, er grene.
Eksempel:

Med hensyn til dets "lukning" kan et carbonhydrid have en lukket, åben eller blandet kæde.
→ Kædekulbrinters lukket eller cyklisk: dem med kæder, hvor atomerne organiserer sig og danner en cyklus, en polygon eller en aromatisk ring (lukket carbonhydrid med skiftevis umættethed). Har ikke løse ender, medmindre der er en gren. Hvert toppunkt på polygonen repræsenterer et kulstof og dets respektive hydrogenbindingsmidler.
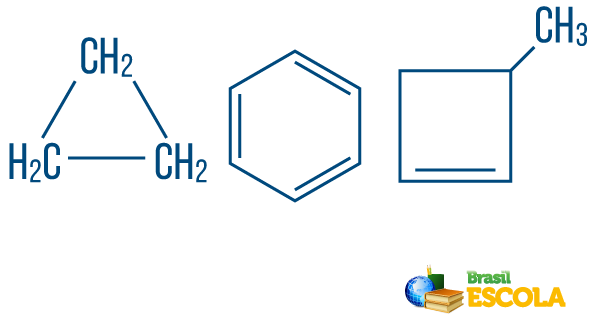
→ Åben kæde eller acykliske kulbrinter: er dem med kæder, der har mindst to ender.

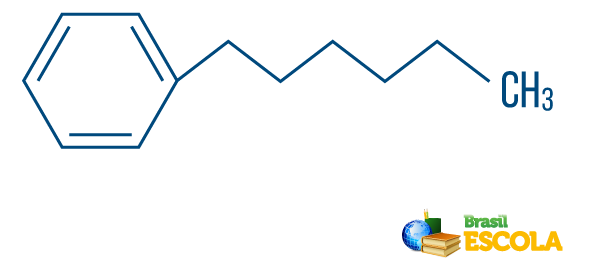
→ Kulbrinte af blandet type streng: er dannet af en ring eller cyklisk kæde fastgjort til en lineær del; det har mindst den ene ende.
Læs også: Aromatiske kulbrinter - eksempler og egenskaber
Nomenklatur for kulbrinter
For hver type kulbrinte er der en navngivningsregel, der er oprettet af Iupac. Nomenklaturen for disse forbindelser udføres som følger:
1. del: filialens (e) lokalitet og navn (hvis nogen)
2. del: udtrykket gælder cyklus hvis forbindelsen er en lukket kæde, men hvis den er en alifatisk (åben) kæde, er det ikke nødvendigt;
3. del: præfiks, der angiver, hvor mange kulstoffer der er i hovedkæden;
4. del: placering og infiks, der indikerer typen af umættethed i molekylet
5. del: suffikset “o” korrekt for kulbrinter.
Hvis molekylet har en åben struktur uden forgrening, starter nomenklaturen i del 3.
Følgende tabel viser de krævede oplysninger (præfiks, infiks og suffiks) for carbonhydridnomenklatur generelt. O præfiks varierer med antallet af kulstoffer O infix, i henhold til antallet af umættelser Det er suffiks“O " henviser til forbindelser af carbonhydridtypen.
Præfiks |
Infix |
Suffiks |
||
1 kulstof |
mødte- |
Kun enkeltopkald |
-an- |
-O |
2 carbonatomer |
et- |
|||
3 carbonatomer |
rekvisit- |
1 dobbeltbinding |
-en- |
|
4 kulhydrater |
men- |
|||
5 carbonatomer |
pent- |
2 dobbeltbindinger |
-dien- |
|
6 carbonatomer |
hex- |
|||
7 carbonatomer |
hept- |
1 tredobbelt binding |
-i- |
|
8 carbonatomer |
okt- |
|||
9 kulhydrater |
ikke- |
2 tredobbelt links |
-diin- |
|
10 carbonatomer |
beslutte |
Det første trin i at opdage nomenklaturen for en organisk forbindelse er identificere hovedkæden af carbonatomer, som skal indeholde umættetheden og så mange sekventielle carbonatomer som muligt. Efter at have identificeret hovedkæden, er kulstof skal opregnes - starter optællingen fra den side, der er tættest på grene og umættetheder (hvis nogen). DET lokalisering vil være antallet af carbon, hvor forgreningen eller umættetheden findes. Nogle gange er der kun en mulig placering for en radikal eller dobbelt eller tredobbelt binding, så det er ikke nødvendigt at udtrykke placeringen af det koblende kulstof i nomenklaturen.

DET nomenklatur for grene vil blive givet ved antallet af kulhydrater i hver plus afslutning linje eller ll. Når der er mere end en gren, bruges alfabetisk rækkefølge.
Se eksemplerne nedenfor:
→ Eksempel 1
CH3 - CH2 - CH3 → Propan
1. del: præfikset “rekvisit-”Angiver, at kæden har tre carbonatomer.
2. del: infikset "-an-”Signalerer, at molekylet kun opretter forbindelser af typen sigma eller simpelt.
3. del: suffikset "-O”Er karakteristisk for kulbrinter.
→ Eksempel 2
CH2= CH-CH2-CH3 → But-1-en
I kulbrinter med umættethed er det nødvendigt at nummerere og lokalisere det kulstof, som parret findes i, og nummereringen skal være så lille som muligt. Til dette skal kulstofantallet starte med den side, der er tættest på dobbeltbindingen.
1. del: "men-" angiver, at der er fire carbonatomer i kæden.
2. del: "1-da" henviser til umættethed placeret mellem kulstof 1 og 2.
3. del: "-O" er det karakteristiske suffiks for kulbrinter.
→ Eksempel 3

1. del: "3-ethyl" signalerer, at der er en to-carbon-gren på carbon 2.
2. del: "-pent-" angiver tilstedeværelsen af fem carbonatomer i hovedkæden.
3. del: "-an-" er infixet anvendt på umættede kæder (ingen dobbelt- eller tredobbeltbindinger).
4. del: "-O" er det karakteristiske suffiks for kulbrinter.
→ Eksempel 4
Til kæder med mere end en gren, placere radikaler i nomenklaturen i alfabetisk rækkefølge. Hvis der er grene og umættetheder i det samme molekyle, skal antallet af carbonatomer i hovedkæden gøres på en sådan måde, at summen af placeringstal er så lille som muligt.
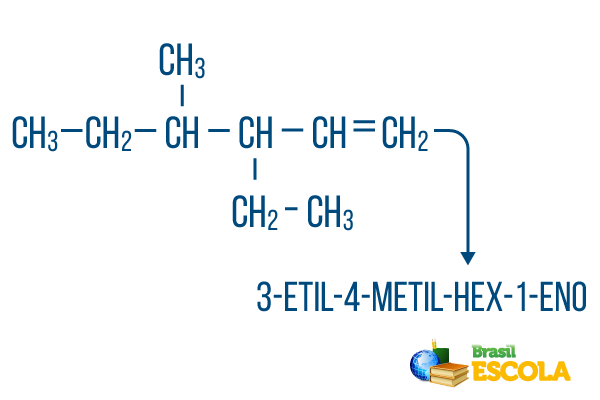
Hovedkædens kulstofoptælling blev udført fra venstre mod højre, og summen af umættetheds- og grenplaceringstallene er: 1 + 4 + 3 = 8. Hvis kulstofantalet havde været fra højre til venstre, ville den sammensatte nomenklatur være 4-ethyl-3-methyl-5-en, hvis sum af placeringer ville være: 4 + 3 + 5 = 12, hvilket er større end den anden hypotese, så den skal ikke bruges.
1. del: 3-ethyl-4-methyl henviser til radikaler i alfabetisk rækkefølge og deres respektive placeringer.
2. del: hex- betyder, at der er 6 carbonatomer i hovedkæden.
3. del: 1-en angiver tilstedeværelsen af en dobbeltbinding på kulstof 1.
4. del: "-O" er det karakteristiske suffiks for kulbrinter.
→ Eksempel 5
For lukkede strenge gælder navngivningsreglerne, men ordet cyklus starter navnet på forbindelsen, hvilket indikerer, at det er et lukket eller cyklisk carbonhydrid.
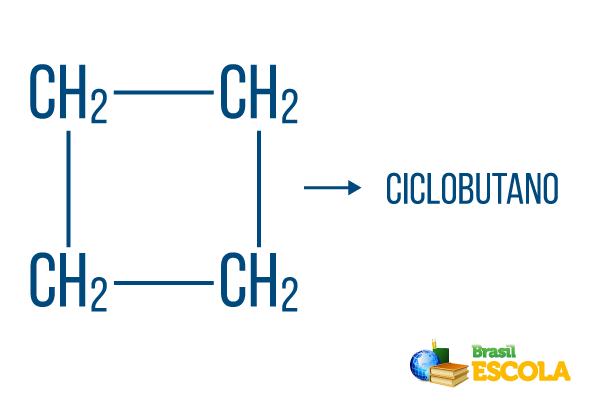
1. del: cyklus- angiver, at det er en lukket streng.
2. del: -men- angiver eksistensen af 4 carbonatomer i kæden
3. del: -Oer det karakteristiske suffiks for kulbrinter.
Læs også: Klassificering af kulstofkæder
Typer af kulbrinter
Kulbrinter kan opdeles i alkaner, alkener, alkyner og alkadiner - som er klassificeret som ifølge etableringen af kæden (dobbelt (e) eller tredobbelte obligationer) - og cyklaner, som er kæderne lukket.
→ Alkaner: er kulbrinter, der ikke har umættethed. Den generelle formel for alkaner er CingenH2n + 2, og ingenomenklatur det er komponeret af præfiks + en + O.
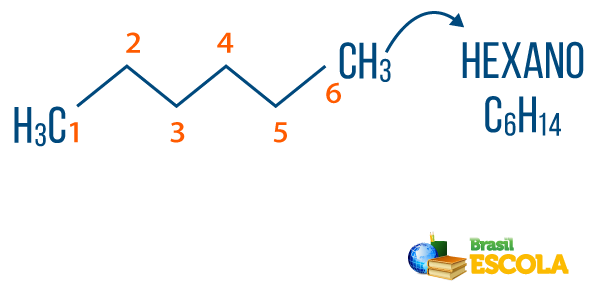
Du alkaner kan findes i naturen, som gas metan (CH4), som frigives af dyr og produceres i nedbrydningsprocesser såvel som i raffinaderier og petrokemiske industrier. Forbindelser som propan (Ç3H7), butan (Ç4H10), som udgør vores kogegas (LPG), og oktan (Ç8H18), der findes i bilbrændstof, er biprodukter fra Olie.

→ alkener eller alkener: er kulstofkæder, der har en umættethed, en dobbeltbinding. Dens generelle formel er CingenH2n, og din ingenomenklatur det er komponeret af Prefix + en + o.

O ethylengas (Ç2H4), der anvendes i landbruget til at fremskynde modningen af frugter, hører til funktionen alken. Forbindelsen anvendes også til produktion af råmateriale polyethylen, der anvendes til fremstilling af plastredskaber.
→ Alkynes eller acetylenisk: kulbrinter med en tredobbelt binding. Dens generelle formel er CingenH2n - 2. DET nomenklatur det er komponeret af præfiks + i + o.

O acetylen eller etin (C2H2) er en gas med den alkynefunktion, der anvendes i svejsninger og metalafskæringer. Denne forbindelse kan nå temperaturer op til 3.000 ° C, hvilket gør det muligt at udføre reparationer på nedsænkede dele af et skib.

→ alkadiener eller diener: kulstofkæder med to umættetheder, det vil sige to dobbeltbindinger mellem carbonatomer. Den generelle formel for denne funktion er C.ingenH2n - 2. Indse, at det er den samme formel som alkyner, hvilket betyder, at det kan ske isomerisme mellem forbindelser (samme molekylformel for forskellige forbindelser).
Nomenklaturen for en alkadien er sammensat af Prefix + dien + o.
Eksempel:

→ Hydrocarboner med lukket kæde: molekylerne organiserer sig på en cyklisk måde, har tendens til at danne en polygon, og som i åbne kæder kan der være etableringer og / eller forgreninger. Cykloner, cyklener, cykliner og benzener er lukkede carbonhydrider.
Cykloner eller cycloalkaner: cykliske kæder, der kun består af enkeltbindinger. Dens generelle formel er CingenH2n. Nomenklatur: ciclo + præfiks + an + o.
Cykler eller cycloalkener: lukkede kulbrintekæder med en virksomhed. Dens generelle formel er CingenH2n-2. Nomenklatur: çiclo + præfiks + da + O.
-
Cykliner eller cycloalkyner: lukkede carbonhydrider med tilstedeværelsen af to dobbeltbindinger. Dens generelle formel er CingenH2n-4. Nomenklatur: çiclo + præfiks + i + o.
benzener
Benzen er en type carbonhydrid med lukket kæde med seks kulhydrater hvor obligationer varierer mellem enkelt og dobbelt. Disse forbindelser er giftig og stærkt kræftfremkaldende, der anvendes som organiske opløsningsmidler i kemiske processer.
For at carbonhydridet skal betragtes som aromatisk, skal der være mindst et benzenring, som er stærkt reaktiv, derfor er underlagt to eller flere udskiftninger, som vi her ser som forgreninger. Når der er to forbindelsesradikaler, vil vi have specifikke navne for hvert par positioner.
Radialer på 1,2 carbonatomer benzen → ortho
Radikaler ved de 1,3 carbonatomer benzen → mål
Radialer på kulstof 1,4 af benzen → til
Annomenklatur for en aromatisk forbindelse udføres som følger:
1. del: placering af ligander (ortho, mål eller til).
2. del: navnet på den eller de radikaler, der er bundet til benzen (methyl, ethyl, propyl ...). Navnet til radikaler følger reglen om andre kulbrinter.
- 3. del: -Bgift, hvilket er det karakteristiske udtryk for aromatiske carbonhydrider.
Eksempler:
→ Ortho-dimethylbenzen

1. del: Orto- angiver, at radikaler er placeret på kulstof 1 og 2.
2. del: -dimethyl- henviser til de to radikaler, begge med et kulstof.
3. del: -benzen er det karakteristiske udtryk for aromatiske carbonhydrider.
→ Ortho-ethyl-methylbenzen
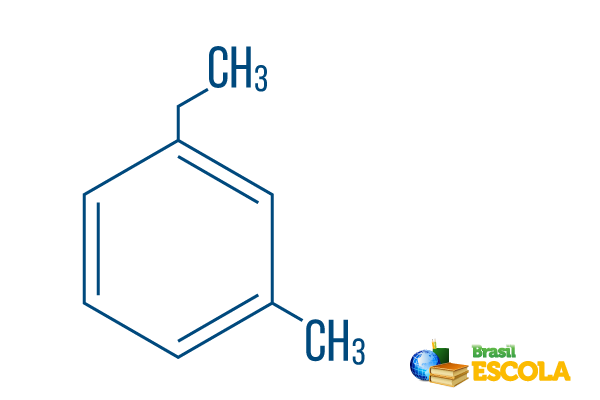
1. del: måh- angiver, at radikaler er placeret på kulstof 1 og 3.
2. del: ethyl-methyl- henviser til mængden af kulstof i hver radikal, værende ethyl Det to-carbon gren og methyl forgrening med et kulstof - placeret i nomenklaturen i alfabetisk rækkefølge.
3. del: -benzen er det karakteristiske udtryk for aromatiske carbonhydrider.
→ para-diethylbenzen
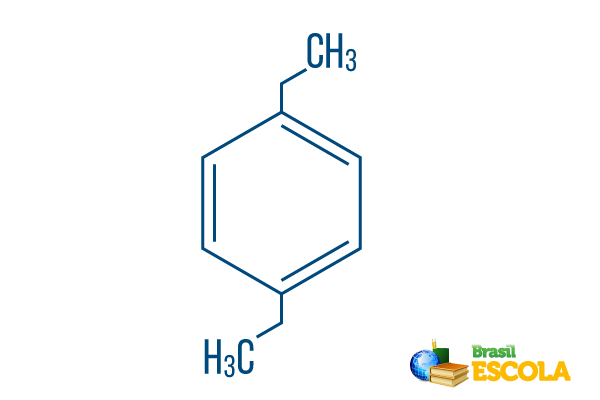
1. del: Ppløje- angiver, at radikaler er på carbon 1 og 4 i benzen.
2. del: -diethyl- henviser til to radikaler af typen ethyl, to grene med to carbonatomer hver.
3. del: -benzen er det karakteristiske udtryk for aromatiske carbonhydrider.
Læs også:Opdagelse af strukturen af benzen
løste øvelser
(Unesp) - Octan er en af de vigtigste bestanddele af benzin, som er en blanding af kulbrinter. Molekylformlen for oktan er:
a) C8H18
b) C8H16
c) C8H14
d) C12H24
e) C18H38
Svar: bogstav a). Analyse af sammensatte nomenklatur oktan, det er en alkan, det vil sige et molekyle, der kun består af enkeltbindinger. Hvis den generelle formel for alkaner er CingenH2n + 2, der erstatter "n" med otte, hvilket er mængden af carbonatomer i hovedkæden - og unik i dette tilfælde - vil vi have, at octans molekylformel er C8H18.
(UFSCar-SP) - Overvej følgende udsagn om kulbrinter.
I) Kulbrinter er organiske forbindelser, der kun består af kulstof og brint.
II) Kun ligekædede umættede kulbrinter kaldes alkener.
III) Cycloalkaner er mættede alifatiske carbonhydrider med den almene formel CnH2n.
IV) Er aromatiske kulbrinter: brombenzen, p-nitrotoluen og naphthalen.
Følgende udsagn er korrekte:
a) kun I og III.
b) Kun I, III og IV.
c) Kun II og III.
d) Kun III og IV.
e) Kun I, II og IV.
Svar: Bogstav a).
II - Alkener er forbindelser med dobbeltbinding, det vil sige umættede, men de kan have forgreninger i deres kæde og ikke udelukkende lineære.
IV - Bromethobenzen- og p-nitrotoluenforbindelserne hører til andre organiske funktioner.
af Laysa Bernardes
Kemilærer
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/hidrocarbonetos.htm



