Virkningen af en katalysator er grundlæggende at fremskynde udviklingen af en bestemt reaktion. Dette er muligt fordi katalysatoren ændrer den mekanisme, hvormed reaktionen fortsætter, hvilket fører til en "alternativ sti", der kræver mindre aktiveringsenergi for at reaktionen kan starte og nå det aktiverede kompleks.
Der er flere typer katalyse, hvoraf den ene er heterogen katalyse, som kan defineres som det, der opstår, når systemet har mere end en fase, dvs. reaktanterne og produkterne er i en fysisk tilstand, der er forskellig fra katalysatorens fysiske tilstand.
Et eksempel, vi kan nævne, er et mellemliggende trin i svovlsyre-dannelse (H2KUN4 (aq)). Dette trin består i dannelsen af svovltrioxid (SO3 (g)) gennem forbrændingsreaktionen af svovldioxid (SO2 (g)):
2 SÅ2 (g) + O2 (g) → 2 OS3 (g)
Da denne reaktion forløber så langsomt, anvendes en katalysator til at fremskynde den. En katalysator, der kan anvendes i dette tilfælde, er divanadiumpentoxid (V2O5 (S)), som er solidt. Da reaktanterne og reaktionsproduktet er gasformige, vil vi have et heterogent system.
Men hvordan kan divanadiumpentoxid fremskynde reaktionen?
Hvad der sker er, at iltreagensets molekyler adsorberes, dvs. tilbageholdes på overfladen af divanadiumpentoxidet. Dette får bindingerne af molekylerne i denne gas til at svækkes over tid, hvilket letter dannelsen af komplekset aktiveres og dermed nedsætter reaktionsaktiveringens energi og øger dens udviklingshastighed, det vil sige dens hastighed.
Stop ikke nu... Der er mere efter reklamen;)
Se hvordan dette sker i nedenstående diagram:
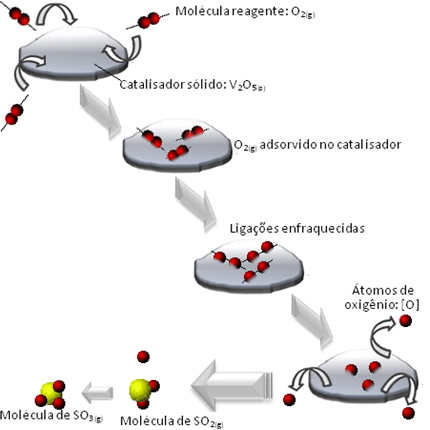
Andre eksempler på heterogen katalyse er vist nedenfor. Bemærk, at i begge tilfælde er reaktanterne og produkterne i luftformige, vandige eller flydende tilstand, mens katalysatorerne er i fast tilstand:
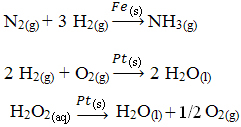
Et eksempel på heterogen katalyse, der finder sted i vores daglige liv, er konvertere bil katalytisk, bedre kendt som katalysatorer. Disse forureningsbekæmpende enheder er overtrukket med stoffer, der fungerer som katalysatorer normalt en legering af palladium og rhodium (til benzinmotorer) og palladium og molybdæn (til benzinmotorer). alkohol).
Inden for denne katalysator opstår kemiske reaktioner, hvor gasser fra ufuldstændig forbrænding, som er mere skadelige for mennesker, omdannes til ikke-giftige gasser. Reaktanter og produkter er alle gasser, hvorimod katalysatorer er faste stoffer.
For at forstå mere om operativsystemets udstyr skal du læse teksten: "Katalysator”.
Af Jennifer Fogaça
Uddannet i kemi
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Heterogen katalyse"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/catalise-heterogenea.htm. Adgang til 27. juni 2021.


