På intermolekylære kræfter, generisk kaldet Van der Waals styrker, der er tre: induceret dipolinduceret dipol, hydrogenbindinger og permanent dipolpermanent dipol. I denne tekst vil vi kun betragte den sidste af disse tre kræfter:
Magten permanent dipol-permanent dipoleller simpelthen dipol-dipol forekommer kun i polære molekylerdet vil sige dem, der ikke har en ensartet belastningsfordeling langs overfladen. For at nævne et eksempel er HCL-molekylet (saltsyre) den elektroniske sky mere fortrængt mod kloratomet, da det er mere elektronegativt end brint.
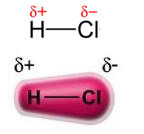
Bemærk, at omkring kloratomet er der en ophobning af elektroner, som forårsager dannelsen af a negativ pol, som er symboliseret med det græske bogstav delta (-δ). Som et resultat i regionen omkring hydrogenatomet a positiv pol (+δ), da den har lav elektronisk tæthed. HCI-molekylet udgør derefter en elektrisk dipol og derfor, når der kommer i kontakt med andre tilstødende HCI-molekyler, er der en tiltrækningskraft mellem de modsatte poler af molekylerne, som det kan ses nedenfor:
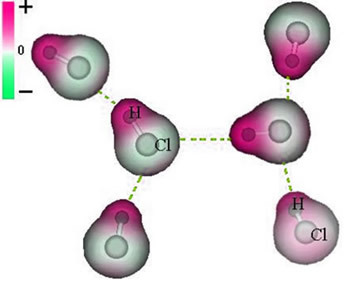
Denne tiltrækkende kraft, der er etableret mellem den negative ende af dipolen af et molekyle og den positive ende af dipolen af et andet molekyle, udgør dipol-dipolkraften..
Så som navnet siger, er dipolen permanent, så den forekommer kun i polære forbindelser. Og jo højere polariteten af et molekyle, jo mere intens er dipol-dipol-interaktionerne i stoffet.
Hvis det er i den faste fase, styrer dannelsen af den permanente dipol positionen for hvert molekyle i rummet og danner dipolære krystaller; som i tilfældet med hydrogenbromid illustreret nedenfor:
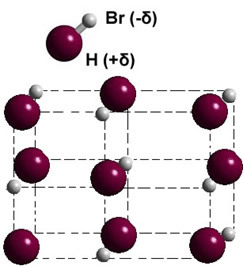
Andre eksempler på polære stoffer, der har dipol-dipolstyrken mellem deres molekyler, er: H2S, CO, HCCl3KUN2.
Denne intermolekylære kraft er af medium intensitet, da den er stærkere end den inducerede dipolinducerede dipolattraktionskraft, men mindre intens end hydrogenbindingen. Dette er grunden til, at deres smelte- og kogepunkter er højere end stoffer, der har en induceret dipolstyrke. Da den permanente dipolkraft er stærkere, er det nødvendigt at levere mere energi til interaktionerne mellem dens molekyler brydes ned.
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm