I dette materiale vil du følge trinvise opløsninger og begrundelser for svar fra forskellige øvelser på kemisk balance, der dækker flere emner i denne vigtige gren af fysisk kemi.
1- Ligevægtskonstant med hensyn til koncentration i mol / L
Eksempel: (PUC-RS) En ligevægt involveret i dannelsen af sur regn er repræsenteret ved ligningen:
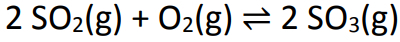
I en 1 liters beholder blev 6 mol svovldioxid og 5 mol ilt blandet. Efter nogen tid nåede systemet ligevægt, og antallet af mol svovletriox målt var 4. Den omtrentlige værdi af ligevægtskonstanten er:
a) 0,53
b) 0,66
c) 0,75
d) 1,33
e) 2,33
Ret svar: Bogstav D
Øvelsen beder om at beregne ligevægtskonstanten i form af mol / L koncentration. For at denne beregning skal udføres, skal vi bruge ligevægtsværdier for hver deltager i reaktionen. Ekspressionen af Kc præsenterer resultatet af multiplikationen af koncentrationerne af produkterne divideret med produktet af koncentrationerne af reagenserne:
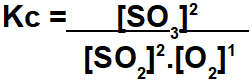
Vi skal være meget omhyggelige med at bestemme værdierne for hver deltager i balancen, da øvelsen ikke altid giver disse data, som det er tilfældet i dette eksempel. Så vi skal følge nedenstående trin:
Trin 1: Saml en tabel med kendte værdier.
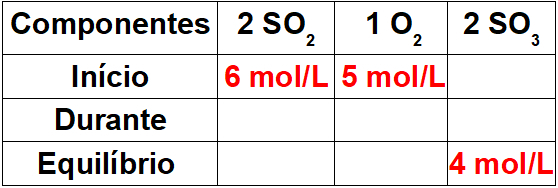
Da dette er begyndelsen på reaktionen, vil produktet have en koncentration lig med nul. Da ligevægtsværdien i produktet altid er lig med summen af debut og under, vil værdien under reaktionen være 4 mol / L.

Trin 2: Bestem værdierne under reaktionen.
For at bestemme værdierne for reagenserne under reaktionen er det nok at relatere den kendte værdi for produktet til værdierne for reagenserne ved hjælp af det støkiometriske forhold. Vi har 4 mol / L SO3 under reaktionen for andelen 2 i balancen. Som andelen af operativsystemet2 er også 2, vi har 4 mol / l under processen. til O2, vil vi kun have 2 mol / L, da dens støkiometriske koefficient er 1.

For at færdiggøre tabellen er det nok at fratrække startværdien med underværdien, så vi bestemmer ligevægtsværdierne for reaktanterne.

Trin 3: Bestem værdien af Kc.
For at bestemme værdien af Kc skal du bare bruge de værdier, der findes i ligevægten i nedenstående udtryk:

2- Ligevægtskonstant med hensyn til partialtryk
Eksempel: (SANTOS-SP) Observer ligevægtsligningen nedenfor:
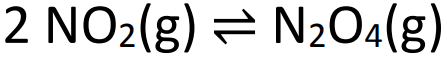
Når ovenstående ligevægt er nået, er trykket 2 atm, og der er 50% NO2 i volumen. Værdien af ligevægtskonstanten i partialtryk (Kp) skal være:
a) 0,2
b) 0,25
c) 1
d) 0,5
e) 0,75
Ret svar: Bogstav C
Øvelsen indikerer, at det samlede systemtryk ved ligevægt er 2 atm, og at der er 50% (molfraktion) af NO2. Så i første omgang skal vi bestemme partialtrykket for hver gas ved ligevægt ved at multiplicere det samlede tryk med den molære fraktion:
til NEJ2:
pNO2 = 0,5. 2
pNO2 = 1 pengeautomat
Til N2O4: da der kun er to gasser i systemet, procentdelen af N2O4 det vil også være 50% for at resultere i i alt 100%.
pN2O4 = 0,5. 2
pN2O4 = 1 pengeautomat
Ligevægtskonstanten, udtrykt i partialtryk, beregnes ved at dividere resultatet af multiplikation af partielle tryk på gasformige produkter med produktet af reagenstryk gasformig. I dette tilfælde vil udtrykket for Kp være:

3- Balanceskift
Eksempel: (PUCCAMP) Dannelsen af stalaktitter, calciumcarbonataflejringer, der findes i huler tæt på kalkstenrige områder, kan repræsenteres ved følgende reversible reaktion:

Overhold følgende betingelser:
JEG. Konstant vandfordampning
II. Kold og fugtig luftstrøm
III. Temperaturstigning inde i hulen
IV. Sænker temperaturen inde i hulen
Hvilke af disse forhold favoriserer dannelsen af stalaktitter?
a) I og II
b) I og III
c) II og III
d) II og IV
e) III og IV
Ret svar: Bogstav B
Stalactitter er strukturer dannet af calciumcarbonat (CaCO3). Erklæringen sætter spørgsmålstegn ved hvilke af de angivne betingelser, der favoriserer dannelsen af stalaktitter. Det er derfor en øvelse om ligevægtsskift, fordi dannelsen af CaCO3 opstår, når balancen forskydes mod din retning (til venstre).
I- Sandt, for når det fordamper, falder mængden af vand (til stede til venstre for balancen). Ifølge princippet om Le Chatelier, når en deltagers koncentration falder, skifter balancen altid til deres side.
II- Falsk, da huler er kolde og fugtige steder, er den direkte reaktion af dannelse af stalaktitter eksoterm. Hvis en strøm af kold, fugtig luft, der favoriserer den eksoterme proces og øger mængden af vand, ind i hulen, vil reaktionen blive forskudt i den direkte retning og ikke favorisere dannelsen af stalaktitter.
III- Sandt nok, da huler er kolde og fugtige steder, og den direkte reaktion er eksoterm, hvis temperaturen i huleforøgelse, vil reaktionen blive fortrængt i den indirekte retning (endoterm), hvilket vil favorisere dannelsen af stalaktitter.
IV- Falsk, da huler er kolde og fugtige steder, og den direkte reaktion er eksoterm, hvis temperaturen i hule fald, vil reaktionen blive forskudt i den direkte retning (eksoterm), hvilket ikke favoriserer dannelsen af stalaktitter.
Se også:Kemisk balance i huler
4- Konstant ionisering
Eksempel: (UECE) Koncentrationen [H+] af en 6 × 10 opløsning-7 mol / liter syre H2S, med en Ki-ioniseringskonstant på 10-7, det er det samme som:
a) 5 × 10-7 mol / liter
b) 6 × 10-7 mol / liter
c) 3 × 10-6 mol / liter
d) 2 × 10-7 mol / liter
Ret svar: Bogstav D
Da vi kun har en syre eller en base, er dette en øvelse omkring ioniseringskonstant (Ki). Så for at løse denne slags spørgsmål skal vi kende koncentrationerne af ioner og elektrolytten (syre eller base).
For at begynde at løse en øvelse på ioniseringskonstanten, skal vi bruge syreioniseringsligningen (i tilfælde af øvelsen, H2S) eller basen.
Stop ikke nu... Der er mere efter reklamen;)

Ifølge den samlede ligning er koncentrationen af H+ er det samme som HS- i ligevægt på grund af den støkiometriske andel. Da vi ikke kender disse værdier, vi bruger x for begge koncentrationer.
Bemærk: vi kan bruge x til begge koncentrationer, fordi vi har at gøre med produktet.
Trin 1: Samling af Ki-udtrykket.
Samlingen af ekspressionen af ligevægtsioniseringskonstanten følger det samme princip for konstanten med hensyn til koncentration i mol / L.
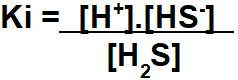
Trin 2: Brug de værdier, som øvelsen giver i det samlede Ki-udtryk.

Trin 3: Beregn deltaværdien.

Trin 4: Beregn den mulige x-værdi for det fundne delta.

For x1
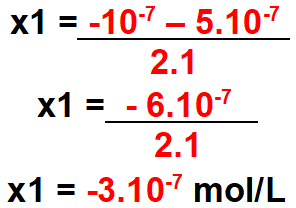
Bemærk: koncentrationen kan ikke være negativ. Så denne værdi er ikke gyldig.
For x2

5- Ostwalds lov om fortynding
Eksempel: (ITA) I en 0,100 mol / l vandig opløsning af en monocarboxylsyre ved 25 ° C dissocieres syren 3,7%, efter at ligevægt er nået. Kontroller den indstilling, der indeholder den korrekte værdi for denne syres dissociationskonstant ved denne temperatur.
a) 1.4
b) 1,4 × 10-3
c) 1,4 × 10-4
d) 3,7 × 10-2
e) 3,7 × 10-4
Ret svar: Bogstav C
igennem Ostwalds lov om fortynding, beregner vi ioniseringskonstanten (Ki) for en stærk elektrolyt (α er større end 5%) ved hjælp af formlen:

For at beregne ioniseringskonstanten for en svag elektrolyt (α er mindre end 5%) bruger vi følgende formel:
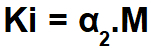
En øvelse på Ostwalds lov om fortynding genkendes let, da den præsenterer en koncentration i mol / l (i dette tilfælde 0,100 mol / l) af en enkelt elektrolyt (monocarboxylsyre), en dissociationsprocent (α = 3,7%) eller dissociations- eller ioniseringskonstanten (Ki).
Da syren er svag, så:

6- Kemisk balance, der involverer pH og pOH
Eksempel: (PUC-MG) I tre beholdere er X, Y og Z indeholdt ukendte basiske opløsninger med en koncentration på 0,1 mol / L. Ved at måle pH af de tre opløsninger med universalindikatorpapir blev henholdsvis følgende værdier opnået: pH = 8, pH = 10 og pH = 13. Marker den KORREKTE sætning:
a) Koncentrationen af OH- af base Z er lig med 10-13 mol / l.
b) Kb fra base X er større end Kb fra base Y.
c) Base Y leder elektrisk strøm bedre end base Z.
d) Base X er fuldstændigt ioniseret.
e) I flaske Z er der en stærk base indeholdt.
Ret svar: Bogstav e
For at begynde at løse denne øvelse er det nødvendigt at huske nogle vigtige punkter:
Først: pH + pOH = 14
Sekund: jo højere pH i forhold til værdien 7, jo mere basisk er løsningen. Jo mere basisk opløsningen er, desto større er koncentrationen af hydroxidanioner [OH-].
Tredje: [OH-] = 10-OH
Værelse: jo mindre pOH, jo større Kb, det vil sige, jo mere ioniseret eller dissocieret vil basen være.
Så baseret på denne viden skal du bare følge trin for trin nedenfor for at løse problemet:
Trin 1: Bestem pOH for hver opløsning.
For løsning X:
pH + pOH = 14
8 + pOH = 14
pOH = 14 - 8
pOH = 6
For løsning Y:
pH + pOH = 14
10+ pOH = 14
pOH = 14 - 10
pOH = 4
For løsning Z:
pH + pOH = 14
13 + pOH = 14
pOH = 14 - 13
pOH = 1
Trin 2: For at bedømme alternativ A skal vi bestemme hydroxidkoncentrationen for opløsning Z.
[åh-] = 10-OH
[åh-] = 10-1 mol / l,
Snart, den alternativ A er falsk.
Trin 3: Sammenlign basen X Kb med basen Y.
Basen X Kb er mindre end basen Y Kb, fordi dens pOH er større. Snart, den alternativ B er falsk.
Trin 4: Associer pOH med styrke og dissociation.
Ledningen af elektrisk strøm forekommer bedst i løsninger, der har en stærk elektrolyt med en højere pOH. Base Y leder ikke elektrisk strøm bedre end base Z, fordi dens pOH er lavere, så færre ioner frigøres. Så alternativ C er falsk.
Trin 5: Forhold pOH med dissociation.
Jo mindre pOH, jo mere dissocieret basen. Da opløsningen med den højeste pOH er i beholder X, indeholder den den mindst dissocierede opløsning. Derfor er den alternativ D er falsk.
Se også: PH i mund og tandforfald
7- Bufferopløsning
Eksempel: (UFES) pH i humant blod holdes inden for et snævert interval (7.35 - 7.45) af forskellige buffersystemer. Påpeg det eneste alternativ, der kan repræsentere et af disse buffersystemer:
a) CH3COOH / NaCl
b) HCI / NaCl
c) H3STØV4 / NaNO3
d) KOH / KCl
e) H2CO3 / NaHCO3
Svaret på dette spørgsmål er alternativet E, fordi dette er en øvelse i bufferopløsning eller buffersystem. Denne opløsning henviser til en kemisk balance dannet af en blanding af to opløsninger: en syre (i træning er H2CO3) eller svag base og et salt, der har den samme syrekomponent (under træning, NaHCO3) eller basen.
a- Falsk, fordi det er en blanding dannet af en svag syre og et salt, der ikke har nogen syrekomponent.
b- Falsk, fordi det er en blanding dannet af en stærk syre, da HCI er en af de tre stærke hydracider (de andre er HBr og HI).
c- Falsk, fordi det er en blanding dannet af en moderat syre og et salt, der ikke har en syrekomponent.
d- Falsk, fordi det er en blanding dannet af en stærk base (den har et element af alkalimetalfamilien).
Se også: Bufferopløsning i humant blod
Af mig Diogo Lopes Dias


