O natriumchlorid (bordsalt) er det salt, vi bruger i vores daglige liv til salt håndlavede eller forarbejdede (industrialiserede) fødevarer. Det er et stof, der også er til stede i forskellige naturlige fødevarer, der forbruges af os dagligt, såsom frugt, grøntsager, bælgfrugter, frø osv.
I denne tekst vil du vide alt om dette vigtige stof for menneskets daglige liv:
definitionen
Natriumchlorid hører til den uorganiske funktion af salte og er sammensat af sammensætningen af natriumkationen (Na+) Det er anion cderoreto (Cl-) gennem en ionbinding.
b) Kemiske egenskaber
Natriumchlorid er dannet af to kemiske grundstoffer:
→ Natrium (Na):
tilhører familien af metaller (i stand til let at danne kationer) alkalisk (AI);
har en elektron i valensskallen;
har atomnummer lig med 11;
har høj elektropositivitet (evne til at miste elektroner).
→ Klor (Cl)
tilhører familien af halogener (VIIA);
det er et ikke-metal (det er derfor, det bliver en anion så let);
har syv elektroner i valensskallen;
har atomnummer lig med 17;
har høj elektronegativitet (evne til at få elektroner).
Da de to kemiske grundstoffer, der danner natriumchlorid, er til stede, henholdsvis høj elektropositivitet og høj elektronegativitet, mellem dem er der en ionbinding (etableret mellem atomer med en tendens til at tabe og vinde elektroner).
Den kemiske struktur af natriumchlorid er sammensat af en enkelt kloranion (grøn kugle), der interagerer med seks natriumkationer (blå kugler), som det kan ses i nedenstående struktur:
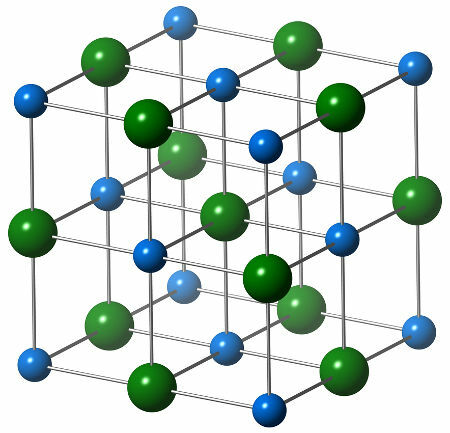
Repræsentation af krystalstrukturen af natriumchlorid
c) Fysiske egenskaber
Fusionspunkt:
Natriumchlorid kan omdannes fra fast tilstand til flydende tilstand ved en temperatur på 801 OÇ.
Kogepunkt:
Natriumchlorid kan omdannes fra en væske til en gasformig tilstand ved en temperatur på 1465 OÇ.
Polaritet
Da det er et stof, der stammer fra en ionbinding, det vil sige, fordi det er en ionforbindelse, er natriumchlorid polært.
Opløselighed i vand
Vi kan opløses i 1 liter vand ved 25 OC, op til 359 gram natriumchlorid.
Opløselighed i andre opløsningsmidler:
Da natriumchlorid er en polær forbindelse, kan det ikke opløses i noget opløsningsmiddel af ikke-polær natur, såsom olie.
Massefylde:
Densiteten af natriumchlorid er 2.165 g / ml, derfor er den tættere end vand, som har en densitet lig med 1 g / ml.
Elektrisk ledningsevne:
Da det er en ionisk forbindelse, er natriumchlorid kun i stand til at lede en elektrisk strøm, når:
Den er i sin smeltede tilstand, dvs. flydende;
Opløst i vand.
d) Metoder til opnåelse
Natriumchlorid kan opnås fysisk eller kemisk:
1O) Bliver fysisk:
fraktioneret krystallisation
Natriumchlorid opnås ved at fordampe vand fra havene.
underjordiske miner
Det ekstraheres i miner ved hjælp af minedriftsteknikker.
underjordiske indskud
Det ekstraheres fra dybe underjordiske aflejringer ved at opløses i vand (saltet i aflejringen opløses) og derefter pumpes.
2O) Opnåelse kemisk
syntese reaktion
Natriumchlorid kan opnås ved den kemiske reaktion ved syntese (enkle stoffer giver anledning til et sammensat stof) mellem klorgas og metallisk natrium:
2 i(s) + Cl2 (g) → 2 NaCl(s)
Neutraliseringsreaktion:
En anden måde at opnå natriumchlorid kemisk på er gennem neutraliseringsreaktionen mellem saltsyre og natriumhydroxid, hvor vi har dannelsen af salt og vand:
HCI(1) + NaOH(her) → NaCl(her) + H2O(1)
e) Betydningen for mennesker
Natriumchlorid i sig selv har ingen funktion i menneskekroppen, men når det adskilles i natriumkationer (Na+) og chloranioner (Cl-), hver af disse to ioner har flere vigtige funktioner for vores krop. Se nogle af disse funktioner:
→ Funktioner af natriumkationen (Na+)
Forhindrer blodpropper
Bekæmper dannelsen af nyre og galdesten;
Deltager i reguleringen af kropsvæsker;
Deltager i reguleringen af blodtryk.
→ Chloridanionens funktioner (Cl-)
Deltagelse i dannelse og konstitution af mavesaft (saltsyre - HCI);
Deltagelse i dannelsen af bugspytkirtelsaft.
f) Skader på menneskekroppen
Overdreven forbrug af natriumchlorid kan forårsage følgende skade for mennesker:
→ Skader forårsaget af overskydende natriumkationer i kroppen:
Øget sårhelingstid
Øget forekomst af kramper;
Øget blodtryk
Nyreoverbelastning;
Øget væskeretention i kroppen.
→ Skader forårsaget af overskydende kloranioner i kroppen:
ødelæggelse af vitamin E;
Fald i jodproduktion i kroppen.
g) Andre anvendelser
Ud over at blive brugt til salt mad, kan natriumchlorid også bruges i følgende situationer:
Shampoo produktion;
Papirproduktion;
Produktion af Natriumhydroxid (NaOH);
Produktion af vaskemiddel;
Sæbe produktion;
Sne, der smelter steder, der lider af snestorm
Produktion af metallisk natrium;
Produktion af klorgas;
I isotonik til udskiftning af kropselektrolyt;
I nasale decongestantopløsninger;
Produktion af saltvand; blandt andre applikationer.
Af mig Diogo Lopes Dias

