Et molekyle er en gruppe af atomer med de samme eller forskellige grundstoffer. Se nogle eksempler:
H2O - molekyle dannet af to forskellige grundstoffer (to hydrogenatomer og et iltatom);
Cl2- molekyle dannet af kun et enkelt kemisk grundstof (to kloratomer).
På molekyler kan klassificeres i polar eller apolar:
ikke-polære: molekyler, der ikke har poler (positive og negative);
polar: molekyler, der har poler (positive og negative).
I denne tekst vil vi understrege polære molekyler. At identificere en polært molekyle, vi kan bruge en af de foreslåede strategier nedenfor:
Det) ionisk forbindelse (dannet ved ionbinding)
Hvis stoffet stammer fra ionbinding (mellem et metal og et ikke-metal) betyder det, at det er dannet af ioner (kation og anion). Derfor præsenteres dette stof automatisk polære molekyler, da ioner har positive og negative ladninger.
Eksempler:
NaCl (Na er et metal, og Cl er et ikke-metal);
CaO (Ca er et metal, og O er et ikke-metal);
MgS (Mg er et metal, og S er et ikke-metal).
B) Molekylære forbindelser (dannet ved kovalent binding)
Når forbindelsen er molekylær, skal vi analysere hvert tilfælde, da vi har muligheden for flere forskellige molekyler. Følgende er nogle eksempler og regler, der kan hjælpe med at bestemme polære molekylære forbindelser:
- Diatomisk molekyle med forskellige elementer
Hvis den molekylære forbindelse består af kun to atomer, og disse to atomer er fra forskellige grundstoffer, automatisk vil molekylet være polært, fordi de to atomer har forskellige elektronegativiteter. Eksempler: HBr og NO.
- Molekyler med to eller flere atomer (samme eller anderledes)
I molekyler, der har et antal atomer større end to, skal vi tage højde for mængden af skyer ligander og ikke-bindemidler til stede i molekylets centrale atom og sammenligner det med antallet af lige atomer bundet til atomet central. De bindende skyer er enkeltbindinger (en elektron fra valensskallen for hvert involveret atom), dobbeltbindinger (to elektroner fra hvert involveret atoms valensskal) eller tredobles (tre elektroner fra hvert atoms valensskal involveret). De ikke-bindende skyer er de par elektroner i valensskallen, der ikke deltager i obligationerne.
Stop ikke nu... Der er mere efter reklamen;)
Observation: For at kende antallet af elektroner i valensskallen af et givet atom, skal du bare kende dets periodiske familie:

For at bestemme, om molekylet er polært, er det nok at kontrollere, om antallet af skyer, der findes i det centrale atom, er forskelligt fra antallet af lige atomer, der er knyttet til det. Se nogle eksempler:
HCN
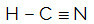
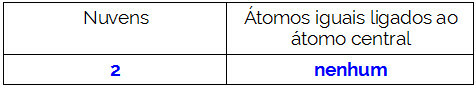
Molekylets centrale atom er kulstof og har to forskellige bindemidler,to bindende skyer (enkelt og tredobbelt) og intet par ikke-bindende elektroner (det er fra VIA-familien, det har fire elektroner i valensskallen og bruger alle fire, en i enkeltbinding og tre i tredobbelt). Af denne grund danner det et polært molekyle.
kort sagt:
NH3
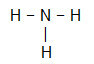
Molekylets centrale atom er nitrogen og har tre lige store ligander og i alt fire skyer, er tre bindende skyer (tre enkeltbindinger) og en ikke-binding (det er fra VA-familien, det har fem elektroner) i valenslaget og bruger kun tre, en i hver enkelt forbindelse, hvilket efterlader to ikke bindemidler).
På grund af dette er det centrale atom i NH3 danner et polært molekyle.
Kort sagt:

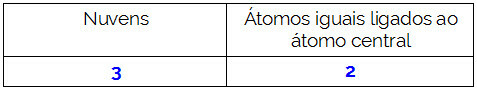
CH2O
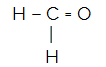
Molekylets centrale atom er kulstof og har to identiske og en forskellige ligander såvel somtre bindende skyer (to enkelt- og en dobbeltbinding), intet par ikke-bindende elektroner (det er fra VIA-familien, det har fire elektroner i valensskallen og bruger 4, to i singlerne og to i par). På grund af dette danner det et polært molekyle.
kort sagt:
Af mig Diogo Lopes Dias
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
DAGE, Diogo Lopes. "Polære molekyler"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/moleculas-polares.htm. Adgang til 28. juni 2021.
Ioniske forbindelser, de vigtigste egenskaber ved ioniske forbindelser, binding mellem ioner, endelig overførsel af elektroner, elektrostatiske tiltrækningskræfter mellem ioner, negative og positive ioner, anioner, kationer, ionbinding, molekylær struktur han
Kemi
Molekylære stoffer, kogetemperatur, kontaktoverflade, kogepunkt, intermolekylære tiltrækningskræfter, kemisk binding, molekylære forbindelser, kovalente kemiske bindinger, ionbindinger, metalbindinger, fysiske tilstande dårligt


