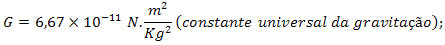Energievnitřní je součet kinetické energie a potenciál související s pohybem jednotlivých atomů a molekul těla. Vnitřní energie je také přímo úměrná teplota z těla. Je to skalární veličina měřená v Joulech (SI) a určená jako funkce proměnných, jako je tlak (P), objem (V) a teplota termodynamika (T) systému v Kelvinech (K).
Čím vyšší je teplota těla, tím větší je jeho vnitřní energie, tím větší je jeho schopnost dělat nějakou práci. Dále je například vnitřní energie monoatomových plynů dána výlučně součtem Kinetická energie každého atomu plynu. Při práci s molekulárními plyny, jako jsou diatomické plyny, je třeba vzít v úvahu molekulární interakce a pro toto, vnitřní energie je určena součtem kinetické energie molekul s potenciální energií existující mezi ony.
Nepřestávejte... Po reklamě je toho víc;)
Vnitřní energie ideálních monoatomových plynů
Protože mezi atomy ideálního monoatomového plynu nedochází k interakci, závisí jeho vnitřní energie výhradně na dvou proměnných: počtu molů (n) a teplotě plynu (T). Hodinky:

U - vnitřní energie
Ne - počet krtků
R - univerzální konstanta dokonalých plynů
T - teplota
Ve výše uvedené rovnici R má modul 0,082 atm. L / mol. K nebo 8,31 J / mol. K (SI). Můžeme také napsat výše uvedenou rovnici, pokud jde o další veličiny, jako je tlak a objem. K tomu si musíme pamatovat Clapeyronova rovnice, který se používá pro ideální plyny.

Dosadíme-li výše uvedenou rovnici za předchozí, budeme mít pro výpočet vnitřní energie následující výraz:

Dívej setaky:Co je to dokonalý plyn?
Vezmeme-li v úvahu výše uvedené rovnice, je možné určit vztah mezi kinetickou energií atomů ideálního monoatomového plynu a jeho teplotou. Za tímto účelem uvedeme, že kinetická energie tohoto typu plynu je čistěkinetika. Hodinky:

m - těstoviny
Ne - krtkové číslo
M - molární hmotnost
V mnoha situacích je zajímavé vědět, jak vypočítat odchylku vnitřní energie (ΔU) plynu, protože toto množství udává, zda plyn obdržel nebo dal v energie. Pokud je změna vnitřní energie plynu pozitivní (ΔU> 0), bude plyn přijímat energii; jinak (ΔU <0) se plyn vzdá části své energie.

Variace vnitřní energie z hlediska změny objemu plynu.
Vnitřní energie pro diatomické plyny
Pro ideální křemeliny je vnitřní energie dána mírně odlišnou rovnicí.

Vnitřní energie v termodynamických transformacích a cyklech
Podle 1. zákon termodynamiky, vnitřní energie ideálního plynu se může v určitých případech lišit termodynamické transformace, v závislosti na množství tepla vyměněného mezi okolím a systémem, jakož i na práci prováděné systémem nebo na něm.

Q - teplo
τ - práce
Dále se podívejme na to, jakou formu má tento zákon pro některé konkrétní termodynamické transformace.
Dívej setaky:Historie tepelných strojů
→ Vnitřní energie: izotermická transformace
Na izotermická transformacenedochází ke změně teploty, a proto vnitřní energie zůstává konstantní.

V tomto případě se celé množství tepla, které se vyměňuje se systémem, promění v práci a naopak.
→ Vnitřní energie: izovolumetrická transformace
Na izovolumetrická transformace, není možné provádět práci, protože systém je uzavřen v pevné a neroztažitelné nádobě. V tomto případě celé množství tepla, které se vyměňuje se systémem, přímo mění jeho vnitřní energii.

→ Vnitřní energie: izobarická transformace
U tohoto typu transformace je systém vystaven a konstantní tlak, proto práci, kterou odvedl on nebo on na něm, lze vypočítat analyticky.

→ Vnitřní energie: adiabatická transformace
V adiabatické transformace, nedochází k žádným výměnám tepla mezi systémem a jeho okolím, proto kolísání vnitřní energie závisí výlučně na práci prováděné systémem nebo na něm.

Vnitřní energie v cyklických procesech
V každém cyklickém procesu je termodynamický stav systému, představovaný jeho tlakovými, objemovými a teplotními proměnnými (P, V, T), transformován, ale nakonec se vrátí do původního stavu (P, V, T), proto je variace vnitřní energie v tomto typu procesu vždy nulová (ΔU = 0).
Dívej setaky:Cyklické transformace
Podívejte se na níže uvedený graf, který ukazuje tři odlišné termodynamické transformace mezi stavy A a B.

Protože tři transformace (I, II a III) opouštějí stav A a přecházejí do stavu B, musí být vnitřní energetická variace pro všechny stejná, proto:

Cvičení vnitřní energie
1) Dva moly ideálního diatomického plynu, s molární hmotností rovnou 24 g / mol, se nacházejí při teplotě 500 K uvnitř uzavřené pevné nádoby s objemem rovným 10-3 m³. Určit:
a) Modul vnitřní energie tohoto plynu v joulech.
b) Tlak, který plyn vyvíjí na stěny nádoby.
Řešení:
The) Jelikož se jedná o ideální a křemelinový plyn, použijeme pro výpočet jeho vnitřní energie následující vzorec:

Vezmeme-li údaje, které byly uvedeny ve výkazu cvičení, budeme muset vyřešit následující výpočet:

B) Můžeme určit tlak, který plyn vyvíjí, jakmile zjistíme objem jeho nádoby: 10-3 m³. K tomu použijeme následující vzorec:

Podle mě. Rafael Helerbrock