Ó vyvažování oxidačně-redukční rovnice je založen na rovnosti počtu rozdaných elektronů s počtem přijatých elektronů. Jednoduchý způsob provedení tohoto vyvážení je dán následujícími kroky:
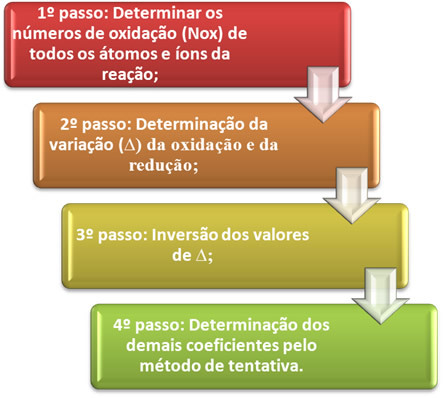
Podívejme se v praxi, jak použít tyto kroky, pomocí následujícího příkladu:
Reakce mezi vodným roztokem manganistanu draselného a kyselinou chlorovodíkovou:
kmnO4 + HCl → KCl + MnCl2 + Cl2 + H2Ó
*1. krok:Určete oxidační čísla:
Tento krok je důležitý, protože obvykle nemůžeme rychle představit, které druhy procházejí oxidací a redukcí.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
kmnO4 + HCl → KCl + MnCl2 + Cl2 + H2Ó
*2. krok:Stanovení oxidační a redukční variace:

Všimněte si, že mangan (Mn) je redukován a chlor (Cl) je oxidován.
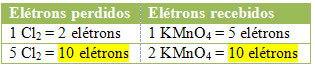
MnCl2 = ∆Nox = 5
Cl2 = ∆Nox = 2
V případě chloru si můžeme povšimnout, že z HCl vznikly 3 sloučeniny (KCl, MnCl2a Cl2), ale to, co nás zajímá, je Cl2, protože je to váš Nox, který utrpěl variace. Každý chlor, který tvoří Cl2 ztratit 1 elektron; protože k tvorbě každého Cl jsou zapotřebí 2 chlory2, pak se ztratí dva elektrony.
3. krok:Inverze hodnot ∆:
V tomto kroku se hodnoty ∆ vyměňují mezi uvedenými druhy a stávají se jejich koeficienty:
MnCl2 = ∆Nox = 5 → 5 bude koeficient Cl2
Cl2 = ∆Nox = 2→ 2 bude koeficient MnCl2
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2Ó
V tomto bodě je již možné znát dva koeficienty rovnice.
Pozorování: normálně se u většiny reakcí toto obrácení hodnot provádí u 1. člena. Obecně by to ale mělo být provedeno u člena, který má největší počet atomů, které podléhají redoxu. Pokud toto kritérium nelze splnit, invertujeme hodnoty pro člen s nejvyšším počtem chemických druhů. To se zde stalo, protože druhý člen má více látek.
Nepřestávejte... Po reklamě je toho víc;)
4. krok: Zkušební vyvážení:
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2Ó
- Protože v druhém členu jsou dva atomy manganu, jak ukazuje koeficient, v prvním musí také být. Takže máme:
2 kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2Ó
- Množství draslíku (K) v 1. členu tedy bylo 2, což bude stejný koeficient pro tento atom ve druhém členu:
2 kmnO4 + HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2Ó
- Množství chloru (Cl) ve 2. členu je celkem 16, takže koeficient HCl pro 1. člen bude:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2Ó
- Počet vodíků v 1. členu je 16, tedy koeficient vody (H2O) druhého člena se bude rovnat 8, protože násobení indexu vodíku (2) o 8 se rovná 16:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2Ó
- Abychom zkontrolovali, zda je rovnice správně vyvážená, vidíme dvě kritéria:
1) Zkontrolujte, zda je množství každého atomu ve dvou členech stejné:
2 kmnO4 + 16 HCl →2 KCl + 2 MnCl2 + 5 Cl2 + 8 hodin2Ó
K = 2K = 2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
2.) Zjistěte, zda se celkový počet ztracených elektronů rovná celkovému počtu přijatých elektronů:
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. "Roxi-redukční vyvážení"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm. Zpřístupněno 28. června 2021.