Ó atomový poloměr (r) je obvykle definována jako poloviční vzdálenost mezi dvěma jádry sousedních atomů, jak ukazuje obrázek níže:

atomový poloměr
Atomový poloměr se liší od jednoho atomu k druhému podle jeho rodiny a období v periodické tabulce. S ohledem na prvky patřící k a stejná rodina, její atomový poloměr se zvyšuje s rostoucím atomovým číslem., to znamená shora dolů. Neboť v tomto smyslu to znamená, že z jednoho atomu na druhý se zvýšila energetická úroveň nebo elektronická vrstva, takže její poloměr se proporcionálně zvyšuje.
S ohledem na prvek ve stejném období, tj. vodorovně, poloměr se zvětšuje zprava doleva nebo se snižuje atomové číslo. Je to proto, že všechny mají stejný počet vrstev, takže rozdíl je v množství elektrony v těchto vrstvách a čím více elektronů, tím větší přitažlivost k jádru, čímž se zmenší poloměr atom.

Směr růstu atomového poloměru podle rodiny a období v periodické tabulce
Atomový poloměr se však může lišit v závislosti na navázaném spojení. Uvidíme, jak se to stane:
* Ionic Bond: Pokud atom tvoří a kation, atomový poloměr se zmenší, protože ztrácí jeden nebo více elektronů, bude jádro přitahovat elektrony intenzivněji. Teď když vytvoří anion, tj. získá elektrony, poloměr atomu se zvětší, protože celkový náboj elektrosféry bude větší než celkový náboj jádra, což snižuje jeho přitažlivost. Čím více elektronů získáte nebo ztratíte, tím větší bude variace velikosti paprsku.
Nepřestávejte... Po reklamě je toho víc;)
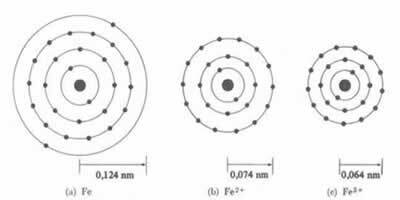
Průměr nebo poloměr kationtu je vždy menší než průměr nebo poloměr atomu
Také v sérii izoelektronické ionty, které mají stejné množství elektronů a energetické úrovně, bude mít iont s nejmenším atomovým číslem větší poloměr. Například ionty 13Al3+, 12mg2+, 11Na1+, 9F-1, 8Ó2- a 7N-3, všechny mají 10 elektronů a 2 elektronické úrovně. Ale co má největší poloměr, je 7N-3, protože má nejmenší atomové číslo (Z = 7).
*Kovalentní vazba: Když dva atomy vytvoří kovalentní vazbu, pokud jsou dva atomy stejné, jako v případě plynného vodíku (H2), lze hovořit o kovalentním poloměru (r), což je polovina délky vazby (d), tj. poloviční vzdálenost oddělující dvě jádra. Ačkoli, pokud je vazba vytvořena různými atomy, jako v případě chlorovodíku (HCl), délka nebo vzdálenost (d) bude součet kovalentních poloměrů (r1 + r2) atomů zapojených do kovalence.
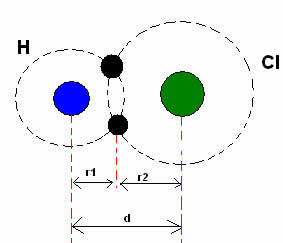
Součet poloměrů atomů v kovalentní vazbě.
Samozřejmě si musíme pamatovat, že tento problém je mnohem komplikovanější, protože kovalentní poloměr atomu se může lišit, protože se váže na jiné různé atomy.
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Atomic Radius Variation in Chemical Bonds“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm. Zpřístupněno 28. června 2021.