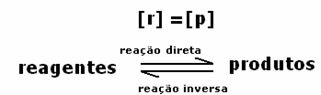
Dynamická rovnováha nebo chemická rovnováha reakce nastává, když k dopředné a zpětné reakci dochází současně. Tyto takzvané reverzibilní systémy jsou znázorněny šipkami v obou směrech:  nebo
nebo  . Na obrázku výše je uveden příklad reverzibilní reakce mezi plynným jodem a plynným vodíkem.
. Na obrázku výše je uveden příklad reverzibilní reakce mezi plynným jodem a plynným vodíkem.
Na začátku reakce je množství reaktantů maximální a množství produktů nulové. Reaktanty však reagují navzájem, snižují jejich koncentraci a zvyšují koncentraci formovaných produktů. Rovněž klesá rychlost vývoje přímé reakce.
Jak se zvyšuje koncentrace produktů, začíná inverzní reakce a reaktanty se znovu tvoří; zvyšuje se také rychlost vývoje inverzní reakce.
Po dosažení chemické rovnováhy při konstantní teplotě jsou rychlosti vývoje dopředné a zpětné reakce stejné.
VšechnoPřímo = Vše inverzní
Sazby jsou stejné, ale koncentrace nejsou. Je nepravděpodobné, že by koncentrace činidel a produktů byly stejné. K tomu dochází pouze ve výjimečných případech. Ve většině případů bude koncentrace činidel vyšší než v produktech nebo naopak.
Máme tedy tři možné způsoby, jak graficky vyjádřit rychlost vývoje přímé a inverzní reakce související s koncentracemi reaktantů a produktů nad čas. Podívejme se na každý případ:
1. případ: Stejné koncentrace:
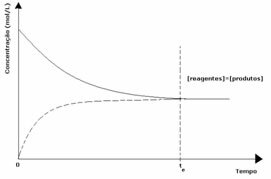
Jak je vidět na grafu, v čase ta dopředná a zpětná reakce jsou stejné, v takovém případě jsou koncentrace reaktantů a produktů stejné. Rovnováha tedy není posunuta na žádnou stranu, intenzita obou reakcí je stejná, jak je uvedeno níže:
Nepřestávejte... Po reklamě je toho víc;)
2. případ: Koncentrace činidel vyšší než koncentrace produktů:
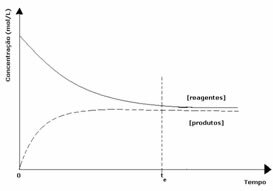
V tomto případě je pozorováno, že při dosažení rovnováhy je koncentrace reaktantů vyšší než koncentrace produktů. Proto se dospělo k závěru, že pokud je reaktantů více, dochází k inverzní reakci s větší intenzitou. Reakce je posunuta doleva:
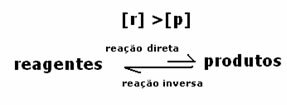
3. případ: Koncentrace produktů vyšší než činidel:
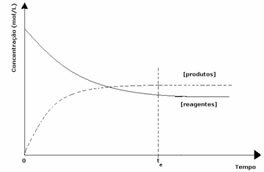
Protože při rovnováze je koncentrace produktů větší, znamená to, že reakce je posunut doprava, protože přímá reakce (s tvorbou produktů) nastává s větší intenzita.
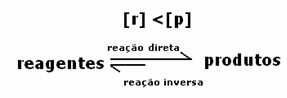
To, co naznačuje, zda má reakce tendenci doprava nebo doleva, bude rovnovážná konstanta K, která závisí pouze na teplotě.
Autor: Jennifer Fogaça
Vystudoval chemii
Tým brazilské školy
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Grafická studie chemické rovnováhy“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm. Zpřístupněno 28. června 2021.
Chemie

Otestujte si své znalosti a dozvíte se více s tímto seznamem řešených cvičení o chemických bilancích. Prostřednictvím tohoto materiálu budete schopni lépe porozumět tomu, jak pracovat s rovnovážnými konstantami (Kp, Kc a Ki), rovnovážným posunem, pH a pOH a také s rovnováhou v takzvaných pufrovacích roztocích.