chemický prvek fosfor (P) patří do třetího období periodické tabulky a do rodiny dusíku (VA). Z tohoto důvodu tvoří jeho atomy obvykle tři chemické vazby dosáhnout teorie oktetů (stabilita). Existují však situace, kdy atom fosforu tvoří více než tři vazby, což je možné pouze prostřednictvím hybridizační jev.
Abychom pochopili hybridizace fosforu, nejprve musíme pochopit, proč atom tohoto prvku vytváří tři vazby. K tomu stačí sledovat vaši elektronickou distribuci:

Elektronická distribuce fosforu
Můžeme pozorovat, že ve valenční vrstvě má atom fosforu úplnou 3s sublevel (s dva elektrony) a neúplná podúroveň 3p (každý ze tří p podúrovní orbitalů má a elektron). Níže máme distribuci elektronů na orbitálech podúrovní Valenční vrstva fosforu:
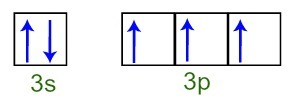
Reprezentace valenčních skořápkových elektronů atomu fosforu
Jelikož je každý z 3p podúrovní orbitalů neúplný, je atom fosforu schopen vytvořit tři chemické vazby, čímž dosáhne stability.
Nyní, když se podíváme na látku PCl5například jsme si jisti, že v této molekule prošel fosfor hybridizací, protože vytvořil pět spojení. Protože chlor, který patří do rodiny VIIA, potřebuje vazbu, aby byl stabilní, a molekula má pět atomů každý z nich musí vytvořit vazbu, díky níž musí atom fosforu také vytvořit pět Připojení. Tento výskyt je možný pouze prostřednictvím
hybridizace (spojení neúplných atomových orbitalů) fosforu.Nepřestávejte... Po reklamě je toho víc;)
Při přijímání energie z vnějšího prostředí se elektrony atomu fosforu vzrušují. Brzy poté se jeden ze dvou elektronů patřících do podúrovně 3s přesune na prázdný orbitál přítomný v podúrovni d, který do té doby nemá žádné elektrony. Viz následující diagram:
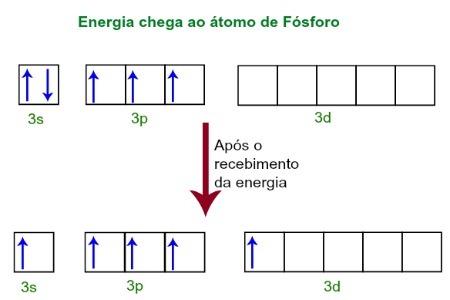
Po přijetí energie jsou elektrony fosforu vzrušeny a jeden zaujímá oběžnou dráhu d podúrovně.
V tuto chvíli máme ve valenční vrstvě fosforu s orbitál, tři p orbitaly a neúplný d orbitál.Nakonec se těchto pět orbitalů hybridizuje, to znamená sloučení, což má za následek pět neúplných atomových orbitalů, které jsou nyní schopné vytvořit pět chemických vazeb.

Hybridizace neúplných atomových orbitalů fosforu
Jelikož byly spojeny orbitál, tři orbitaly orbitál d, hybridizace fosforem je typu sp3d.
Podle mě. Diogo Lopes Dias
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
DNY, Diogo Lopes. „Hybridizace fosforu“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm. Zpřístupněno 28. června 2021.