Kyseliny jsou látky, které ionizovat ve vodném prostředí a jsou dobří vodiče Napájení. Kyselost látky lze měřit pomocí technik pro měření vodíkového iontového potenciálu (pH) řešení. Některé analytické metody pH používají ukazatele, jako je lakmus nebo fenolftalein, které odrážejí hodnotu pH roztoku barevně.
Kyseliny lze charakterizovat:
přítomností či nepřítomností kyslíku v jeho molekule;
silou;
ionizovatelnými vodíky;
jeho volatilitou.
Přečtěte si také:Srovnání mezi kyselinami a zásadami - rozdíly a vlastnosti
Vlastnosti kyselin
Ionizují ve vodném prostředí a uvolňují kation H+.
Jsou to vodiče elektřiny v důsledku uvolnění ionty ve vodném médiu.
Při kontaktu se základním prostředím trpí neutralizační reakce, tvořící sůl a vodu jako produkty této reakce.
Mění barvu roztoku v přítomnosti indikátorové látky, jako je lakmusový kamínek nebo fenolftalein.
Kyselá chuť citronu, pomeranče, mimo jiné citrusových plodů, je způsobena kyselinou přítomnou v těchto potravinách.
Nepřestávejte... Po reklamě je toho víc;)
Vodíkový potenciál (pH)
Potenciál vodíkových iontů (pH) je výpočet, který vyjadřuje iontová koncentrace vodík v jistém řešení. Při stanovení pH a analýze média se berou v úvahu následující:
Ostwaldův zákon ředění (čím zředěnější, tím více iontů se v roztoku vytvoří);
autoionizace vody (Kw), což je přirozený rozklad molekuly H2O v H iontech+ a oh-;
destilovaná voda při 25 ° C má autoionizaci Kw = 10-14 a stejná koncentrace iontů H+ a oh-, tj. Je to neutrální médium.
Pro výpočet pH zahrnující koncentraci H.+, použití: pH = -log [H+].
Vím, že:
pH> 7 → bazický roztok
pH <7 → kyselý roztok
pH = 7 nebo pH = pOH → neutrální roztok
Podívejte se také: Jaké jsou kyselé vzorce?

Klasifikace kyselin
THE klasifikace kyselin lze provést s přihlédnutím ke čtyřem různým kritériím.
Stupeň ionizace (α) nebo síla kyseliny
α = počet ionizovaných molekul
počet rozpuštěných molekul
Silné kyseliny: α ≥ 50%.
Příklad: ákyselina sírová (H2POUZE4) → α = 61%.Polosilné nebo středně silné kyseliny: 5% < α < 50%.
Příklad: kyselina fosforečná (H3PRACH4) → α = 27%.Slabé kyseliny: α ≤ 5%.
Příklad: kyselina boritá (H3BO3) → α = 0,075%.
→ Počet ionizovatelného vodíku
monoacid: uvolňuje kationt H.+.
Příklad: ákyselina chlorovodíková (HCL);
dikyselina: uvolňuje dva H kationty+.
Příklad: sirovodík (H2S).Triacid: uvolňuje tři H kationty+.
Příklad: kyselina boritá (H3BO3).tetracidní: uvolňuje čtyři H kationty+.
Příklad: kyselina pyrofosforečná (H4P2Ó7).
Pozornost! V případě hydracidů jsou všechny vodíky v molekule ionizovatelné; ale v případě kyslíkových kyselin jsou ionizovatelné pouze vodíky, které jsou navázány na atom kyslíku. Příkladem je kyselina fosforná (H3PRACH2), což je monokyselina, protože i když má ve svém složení tři vodíky, uvolňuje pouze vodík, který je vázán na kyslík.
→ Přítomnost kyslíku
oxykyseliny: mají ve své struktuře kyslík.
Příklad: kyselina chlorná (HO Cl).
Hidracidy: nemají ve své struktuře kyslík.
Příklad: kyselina fluorovodíková (HF).
→ Volatilita
Pevný: bod varu(CHODIDLO) > 100 ° C, pomalu přecházející do plynného stavu.
Příklad: kyselina sírová (H2POUZE4) → PE = 340 ° C.těkavé látky: bod varu <100 ° C, rychle a snadno přecházející do plynného stavu.
Příklad: sirovodík (H2S) → PE = -59,6 ° C.
Kyselinová nomenklatura
→ Hidracidy
Kyselina + název aniontu + hydr
Pro všechny kyseliny se před nomenklaturou, která charakterizuje molekulu, používá termín „kyselina“. V hydracidech je přípona „eto“ názvu prvku nahrazena „hydric“.
Příklady:
HCl → kyselina chlórhydr
HBr → kyselina bromhydr
HF → kyselina fluorhydr
→ oxykyseliny
Názvosloví kyslíkatých kyselin se liší podle oxidační číslo (NOX) centrálního prvku. Viz tabulka níže:
NOX centrálního prvku |
Kyselinová nomenklatura |
||
předpona- |
-infix- |
-přípona |
|
+1 a +2 |
Hroch- |
-anion jméno- |
-oso |
+3 a +4 |
-- |
Anion name- |
-oso |
+5 a +6 |
-- |
Anion name- |
-ic |
+7 |
Za |
-anion jméno- |
-ic |
Příklady:
HClO → S vědomím, že vodík (H) má normálně NOX +1 a kyslík (O) má NOX -2, abychom měli molekulu náboje 0, musí mít chlor (Cl) NOX +1, takže nomenklatura této kyseliny je kyselina chlorná.
HNO2 → kyselina dusitá
HClO4 →ákyselinaperchloric
→ Výjimky z pravidla
H2CO3 → kyselina uhličitá, a ne uhlíkatý, jak by tomu bylo za pravidla NOX.
H3BO3 → ákyselina boric, a není nudný.
Kyseliny v každodenním životě
Hnojiva a léky: Kyselina fosforečná (H3PRACH4) se široce používá při výrobě hnojiv a také jako léčivo. Je to jedna z několika kyselin, které se používají ve farmaceutické oblasti.
Citrusové plody: mít kyselinu askorbovou (C.6H8Ó6), také známý jako Vitamín C.
Ocet: má ve svém složení Octová kyselina (CH3COOH).
- Perlivá voda a nealkoholické nápoje: složený z kyseliny uhličité (H2CO3), který dodává výrobku osvěžující pocit.
Také přístup:Úloha kyselin v nealkoholických nápojích

vyřešená cvičení
Otázka 1 - (Enem) Šťáva získaná z červeného zelí může být použita jako indikátor kyselého charakteru (pH mezi 0 a 7) nebo zásaditý (pH mezi 7 a 14) různých roztoků. Smícháním malého zelného džusu a roztoku začne směs vykazovat různé barvy podle své kyselé nebo zásadité povahy podle níže uvedené stupnice.
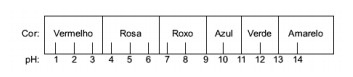
Některá řešení byla testována s tímto indikátorem, což přineslo následující výsledky:
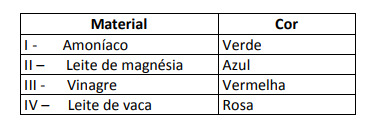
Podle těchto výsledků mají řešení I, II, III a IV následující charakter:
A) kyselé / zásadité / zásadité / kyselé.
B) kyselina / zásaditá / kyselina / zásaditá.
C) zásaditý / kyselý / zásaditý / kyselý.
D) kyselina / kyselina / zásaditá / zásaditá.
E) Základní / Základní / Kyselina / Kyselina.
Řešení
Alternativa E. Za účelem zjištění, zda má látka kyselý, zásaditý nebo dokonce neutrální charakter, se provede analýza barev získaných při zkoušce ve vztahu k údajům dané stupnice. S vědomím, že roztoky s pH = 7 jsou neutrální, pH> 7 jsou zásadité a s pH <7 jsou kyselé, dospěli jsme k závěr, že čpavek a hořčíkové mléko jsou základní látky, a ocet a kravské mléko ano kyseliny.
Otázka 2 - (PUC-Camp) Pokud jde o látky zvané kyseliny, student zaznamenal následující vlastnosti:
I - mám korozivní sílu;
II - jsou schopné neutralizovat báze;
III - jsou složeny ze dvou chemických prvků;
IV - tvoří vodné roztoky, které vedou elektrický proud.
Udělal chyby POUZE v
A) I a II
B) I a III
C) I a IV
D) II a III
E) III a IV
Řešení
Alternativa B. Ne všechny kyseliny jsou korozivní, pouze ty nejsilnější a kyseliny mohou být složeny ze dvou nebo více atomů.
Laysa Bernardes
Učitel chemie
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
ARAúJO, Laysa Bernardes Marques de. „Kyseliny“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/acidos.htm. Zpřístupněno 27. června 2021.

