THE entalpie formace, také zvaný standardní entalpie formacenebo standardní teplo formace, je výpočet tepla uvolněného nebo absorbovaného při tvorbě 1 molu látky z jednoduchých látek ve standardním stavu.
Je nemožné vypočítat absolutní hodnotu entalpií každé látky, ale je možné vypočítat odchylku entalpie, ke které dochází při reakci, pomocí kalorimetru.
Je nutné si to pamatovat bylo dohodnuto přijetí hodnoty entalpie rovné nule pro jednoduché látky ve standardním stavu. Chceme-li tedy zjistit, co je entalpie vzniku látky, stačí nám znát hodnotu entalpie její reakční reakce z jednoduchých látek.
Například chceme najít entalpii 18 gramů vody, což odpovídá 1 mol, protože její molární hmotnost je 18 g / mol. Abychom to mohli udělat, nejprve potřebujeme reakci k vytvoření vody z jednoduchých látek, jak je uvedeno níže:
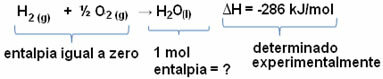
Všimněte si, že hodnota změny entalpie, ke které došlo v této reakci, byla experimentálně stanovena pomocí kalorimetru a rovná se -286 kJ / mol.
Vzorec pro výpočet této změny entalpie (ΔH) je:
ΔH = Hprodukty - HČinidla
Jelikož tedy již víme hodnotu ΔH a že entalpie reaktantů je rovna nule (protože jsou to standardní látky ve standardním stavu), můžeme dojít k závěru že hodnota entalpie 1 mol vody se rovná entalpické změně formační reakce, protože je to jediný produkt této reakce, jak je znázorněno níže:
ΔH = Hprodukty - HČinidla
-286 kJ / mol = HH2O - (HH2 + H1/2 Ó2)
-286 kJ / mol = HH2O - 0
HH2O = - 286 kJ / mol
Nepřestávejte... Po reklamě je toho víc;)
Tento typ entalpie, dosažený z entalpie jednoduchých látek ve standardním stavu, je tedy standardní entalpie tvorby (ΔH0).
Nyní existuje mnoho látek, které se netvoří přímo jedinou reakcí, jako je voda. V takových případech lze entalpii formace vypočítat z variace entalpie reakce.
Například NH4Cl vzniká následující reakcí:
NH3 + HCl → NH4Cl ΔH = -176 kJ / mol
Všimněte si, že žádný z reaktantů není jednoduchá látka, takže jim nemůžeme přiřadit nulovou entalpii. Musíme znát entalpie tvorby každého z činidel, protože jsou tvořeny reakcemi mezi jednoduchými látkami:
NH3: ΔH = -46 kJ / mol
HCl: ΔH = -92,4 kJ / mol
Sečtením těchto dvou entalpií dostaneme hodnotu entalpie reaktantů a najdeme entalpii NH4Cl:
HR = HNH3 + HHCl
HR = (-46 + (-92,4) kJ / mol)
HR = -138,4 kJ / mol
Nahrazení ve vzorci:
ΔH = Hprodukty - HČinidla
-176 = HNH4CI - ( -138,4)
HNH4CI = - 176 - 138,4
HNH4CI = -314,4 kJ / mol
V tomto případě jsme přímo sčítali hodnoty entalpií tvorby reaktantů, protože reakční poměr byl pouze 1 mol. Pokud je však v jiných reakcích množství molů odlišné, bude nutné nejprve vynásobit entalpii tvorby reaktantu počtem molů.
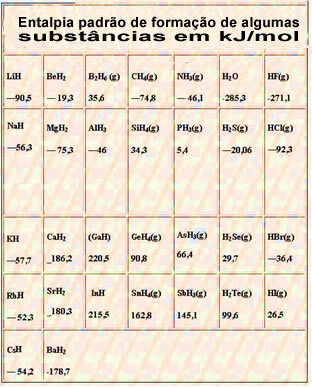
Níže je tabulka se standardní entalpií tvorby některých látek při 25 ° C a 1 atm:
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. "Entalpie formace"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm. Zpřístupněno 27. června 2021.