Fúze je změna z pevného stavu do kapalného stavu. Nastává, když tělo vystavené danému tlaku přijímá teplo a jeho teplota dosáhne určité hodnoty.
Množství tepla, které musí tělo přijmout, aby se stalo zcela tekutým, závisí na látce, která jej tvoří.
Obecně řečeno, když je látka v pevném stavu, má dobře definovaný tvar. Jeho atomy jsou úhledně uspořádány do struktury zvané a krystalická síť.
Když přijme teplo, atomy, které tvoří pevnou látku, zvyšují svou vibraci a zvyšují svou teplotu.
Pokud se příchozí energie zvýší, vibrace atomů rozepnou krystalickou mřížku a tělo přejde do kapalného stavu.

Zákony o spojování
- Při udržování konstantního tlaku zůstává teplota během procesu tavení konstantní.
- Množství tepla na jednotku hmotnosti se nazývá latentní teplo fúze a je vlastností látky.
- Teplota, při které se každá látka taje, je dobře určena a nazývá se fúzní bod.
Když je vystavena tlaku 1 atmosféry, voda taje při 0 ° C, zatímco teplota tání železa je 1,535 ° C a chloru je 101,5 ° C.
Množství latentního tepla
Množství tepla potřebné pro tělo ke změně stavu závisí na hodnotě latentní teplo fúze a hmotnosti těla.
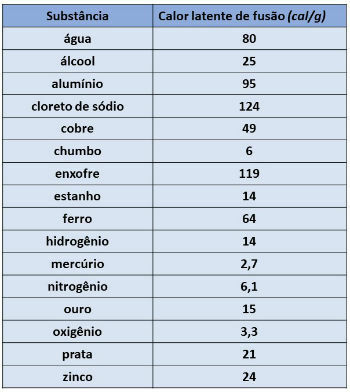
Hodnota latentního tepla se liší podle látky, která tvoří tělo. V tabulce níže uvádíme hodnoty některých látek.
Vzorec
Množství tepla potřebné pro tělo ke změně fáze je dáno vzorcem:
Bytost,
Q: množství latentního tepla (vápno)
m: hmotnost (g)
LF: latentní teplo fúze (cal / g)
Pamatujte, že vzorec pro množství tepla ve fázové změně nebere v úvahu teplotní výkyvy.
Je to proto, že celé množství přijatého tepla se používá k rozbití krystalové mřížky, přičemž se během procesu udržuje konstantní teplota.
Příklad
Kolik tepla je zapotřebí k úplnému roztavení bloku zlata o hmotnosti 200 g?
Latentní teplo fúze zlata se rovná 15 cal / g (tabulka výše), takže budeme mít:
Q = 200. 15 = 3000 kcal nebo 3 kcal
Chcete-li se dozvědět více, přečtěte si také:
- Změny fyzického stavu
- Fyzikální stavy hmoty
- Fyzikální stavy vody
- Vlastnosti hmoty
- Fázový diagram
- Zkapalnění nebo kondenzace
- Vařící
- Vypařování
- Sublimace
- Tuhnutí
- Elektrolýza
- Vypařování


