Ó výpočet počtu atomových částic se používá k označení množství protonů (v jádře), elektronů (v elektrosféře) a neutronů (v jádru) přítomných v jakémkoli atomu nebo iontu. K tomu je nezbytné znát některé vlastnosti atomů:
1- Atomové číslo (Z)
Jedná se o matematický kód, představovaný velkým písmenem Z, umístěný na levé dolní straně zkratky atomu:
ZX
Udává počet protonů (p) v jádru a počet elektronů (e) v elektrosféře atomu. Obecně tedy:
Z = p = e
2 - hromadné číslo (A)
Jedná se o matematický kód, který odpovídá součtu počtu protonů (p) a neutronů (n), oba přítomné v jádru libovolného atomu. Rovnice, která představuje číslo hmotnosti, je dána vztahem:
A = p + n
Vzhledem k tomu, že počet protonů se rovná atomovému číslu, můžeme napsat rovnici a vypočítat hmotnostní číslo následujícím způsobem:
A = Z + n
Pokud známe hmotnostní číslo a atomové číslo atomu, můžeme určit počet neutronů následovně:
n = A - Z
3- ionty
Jsou to atomy, které ztrácejí nebo získávají elektrony. Mají kladné nebo záporné znaménko umístěné v pravém horním rohu své reprezentace, jako v následujícím modelu:
X+ nebo X-
Kladný iont: Toto se nazývá kation a kladné znaménko znamená, že ztratil elektrony.
Negativní ion: Tomu se říká anion a záporné znaménko znamená, že získal elektrony.
4- Atomové podobnosti
a) Izotopy
Atomy, které mají stejné atomové číslo a různá hmotnostní čísla. Příklad:
7X14 a 7Y16
Atomy X a Y mají stejné atomové číslo (nalevo od zkratky), tedy rovno 7. Atom X má hmotnostní číslo (napravo od zkratky) rovné 14 a atom Y má hmotnostní číslo rovné 16.
b) Isobars
Atomy, které mají stejné hmotnostní číslo a různá atomová čísla. Příklad:
15X31 a 13Y31
Atomy X a Y mají hromadné číslo (napravo od zkratky) rovné 31. Atom X, na druhé straně, má atomové číslo rovné 15 a atom Y má atomové číslo rovné 13.
c) izotony
Atomy, které mají různá hmotnostní a atomová čísla, ale stejný počet neutronů.
d) Isoelektronika
Atomy, které mají stejný počet elektronů. Příklad:
12X+2 a 7Y-3
Atom X má atomové číslo rovné 12 a je to kation (s kladným nábojem +2), takže ztrácí dva elektrony, čímž má ve své elektrosféře 10 elektronů. Atom Y, na druhé straně, má atomové číslo rovné 7 a je to anion (se záporným nábojem -3), takže získává tři elektrony, čímž má ve své elektrosféře 10 elektronů.
Myšlenková mapa: atomové částice
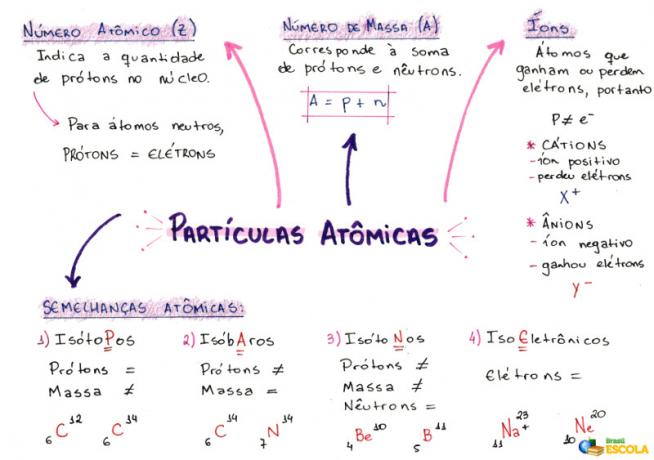
* Chcete-li stáhnout myšlenkovou mapu v PDF, Klikněte zde!
Příklady výpočtu počtu atomových částic
Příklad 1: Určete počet protonů, neutronů a elektronů v atomu 14X29.
Byly uvedeny následující hodnoty pro atom X:
Hmotnost (vpravo nahoře) = 29
Atomové číslo (vlevo dole) = 14
Určení počtu protonů:
Počet protonů se vždy rovná atomovému číslu, takže atom X má 14 protonů.
Určení počtu elektronů:
Protože atom X není iont, počet elektronů se rovná počtu protonů, tj. 14.
Určení počtu neutronů:
Počet neutronů se stanoví pomocí počtu hmotností a protonů v následujícím vzorci:
A = p + n
29 = 14 + n
29-14 = n
n = 15
Příklad 2: Určete počet protonů, neutronů a elektronů iontu X+3s vědomím, že jejich hmotnostní číslo a atomové číslo jsou 51, respektive 23.
Byly uvedeny následující hodnoty pro iont X:
Hmotnost číslo = 51
Atomové číslo (vlevo dole) = 23
Určení počtu protonů:
Počet protonů se vždy rovná atomovému číslu, takže atom X má 23 protonů.
Určení počtu elektronů:
Iont X je kladný (+3), jedná se tedy o kation, který ztratil tři elektrony. Takže jeho počet elektronů je 20.
POZNÁMKA: Snížení nebo zvýšení počtu elektronů nastává vždy ve vztahu k atomovému číslu.
Určení počtu neutronů:
Počet neutronů se stanoví pomocí počtu hmotností a protonů v následujícím vzorci:
A = p + n
51 = 23 + n
51 - 23 = n
n = 28
Příklad 3: Atom W má atomové číslo a hmotnost rovnou 29, respektive 57, přičemž je stejný jako a atom Y, který má atomové číslo rovné 30, což je izotop atomu B, jehož hmotnostní číslo je 65. S touto informací určete počet protonů, neutronů a elektronů v atomu B.
Údaje poskytnuté cvičením:
Atom W
atomové číslo (vlevo dole) = 29
hromadné číslo (vpravo nahoře) = 57
Y isobar, tj. Hmotnost Y je také 57.
Atom Y.
atomové číslo = 30
hmotnost číslo = 57
S těmito dvěma hodnotami musíme určit jeho neutronové číslo, protože je izotonním prvku B:
A = Z + n
57 = 30 + n
57 - 30 = n
n = 27
Atom B:
hmotnost číslo = 65
počet neutronů = 27
S těmito daty musíme určit jeho atomové číslo, protože s tím budeme určovat jeho počet protonů a počet elektronů (protože to není iont):
A = Z + n
65 = Z +27
65 - 27 = Z
Z = 38
Atom B má tedy 38 protonů, 38 elektronů a 27 neutronů.
* Mind Map od Victora Ricarda Ferreiry
Učitel chemie
Podle mě. Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/calculo-das-particulas-atomicas.htm

