Pokud použijeme voltmetr v baterii, budeme schopni identifikovat rozdíl v potenciálu (U nebo ddp) nebo elektromotorické síle (emf nebo E) mezi oběma elektrodami. Tímto způsobem však není možné určit redukční nebo oxidační potenciál každé elektrody.
Vědci potřebovali tyto hodnoty znát ke studiu oxidačně-redukčních procesů, proto založili a referenční stav. To znamená, že bylo dohodnuto měřit potenciál každé elektrody ve vztahu k jiné elektrodě za následujících standardních podmínek:
• Teplota musí být 25 ° C;
• Tlak při 1,0 atm;
• Koncentrace roztoku, ve kterém je kov ponořen, musí být 1,0 mol / l.
Zvolenou elektrodou tedy byla vodíková elektroda, který je znázorněn níže:
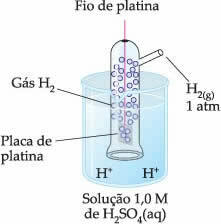
Tato elektroda se skládá z platinového drátu připojeného k platinové desce, která se neúčastní reakce, uvnitř trubice obsahující plynný vodík a ponořené v kyselém roztoku. V příkladu byl roztokem kyselina sírová.
| Podle konvence byla standardní vodíkové elektrodě přiřazena hodnota nula, tolik pro E.0Červené pokud jde o E0kyslík. |
Abychom tedy našli potenciální hodnotu jakékoli jiné elektrody, jednoduše vytvoříme hromadu elektrody, kterou chceme, se standardní vodíkovou elektrodou a změříme ddp voltmetrem. Hodnota zobrazená na voltmetru bude potenciálem hledané elektrody, protože potenciál vodíku se rovná nule.
Například propojíme zinkovou elektrodu s vodíkovou elektrodou, abychom zjistili, jaký je její redukční potenciál:
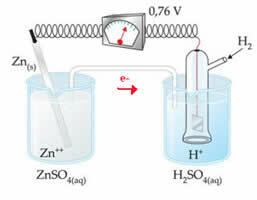
Podle výše uvedeného schématu voltmetr identifikoval potenciální rozdíl rovný +0,76 (? E0 = +0,76). Také si povšimneme, že zinková elektroda oxidovala, takže je to anoda; a vodíková elektroda se zmenšila, což byla katoda.
Takže máme:
? E0 = E0red (katoda) - E0 červená (anoda)
0,76 = 0,00 - E0 červená (Zn)
E0 červená (Zn) = 0,00-0,76
E0 červená (Zn) = -0,76
Záporná hodnota znamená, že elektronový proud proudí ze zinkové elektrody (anody) na vodíkovou elektrodu, takže se chová jako katoda. Pokud by to bylo kladné, bylo by to obráceně a vodíková elektroda by se chovala jako anoda. To lze vidět, když propojíme měděnou elektrodu se standardní vodíkovou elektrodou:
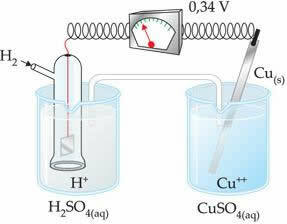
? E0 = E0red (katoda) - E0 červená (anoda)
-0,34 = 0,00 - E0 červená (Zn)
E0 červená (Zn) = 0,00 + 0,34
E0 červená (Zn) = +0,34
Je tedy možné definovat redukční a oxidační potenciál pro nejrůznější chemické druhy. Mezinárodní unie pro čistou a aplikovanou chemii (IUPAC) však doporučuje používat pouze redukční potenciály. A bez ohledu na použitý kov je v zobrazení baterie vodíková elektroda vždy na prvním místě, například:
Pt - H2 (g) 1 atm / H3O1 + (aq) 1 mol / L // Cu2 + (aq) 1 mol / L / Cu
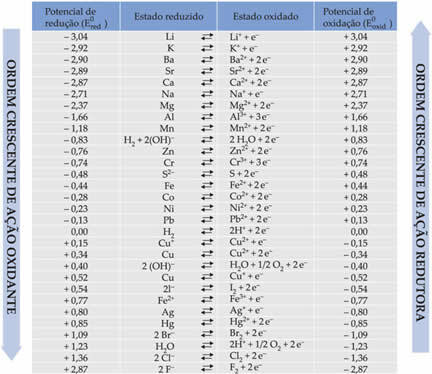
Níže v tabulce jsou uvedeny potenciály dosažené touto metodou použití standardní vodíkové elektrody spolu s jejich příslušnými poloreakcemi:
Autor: Jennifer Fogaça
Vystudoval chemii
Tým brazilské školy
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/medicao-dos-potenciais-eletroquimicos.htm


