THE hydrolýza solí mezi silnými kyselinami a zásadami nastává, když kation v soli neinteraguje s aniontem ve vodě a anion v soli neinteraguje s kationtem ve vodě. K hydrolýze mezi kationty a anionty soli a vody dochází, pouze pokud je vytvořeným produktem slabá kyselina, slabá báze nebo obojí. Pochopte hydrolýzu solí mezi silnými kyselinami a silnými zásadami krok za krokem:
a) Krok 1: ionizace vody
Voda je látka, která má schopnost trpět autoionizace, to znamená, že produkuje hydroniový kation (H+) a hydroxidový anion (OH-) ze své struktury.
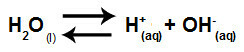
Rovnice představující samoionizaci vody
b) Krok 2: Disociace soli
Když se sůl přidá do vody, prochází procesem disociace. Protože sůl je iontová sloučenina, ve vodě se její kationty a anionty uvolňují do média, jak je uvedeno v rovnici níže:
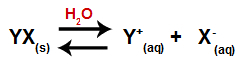
Rovnice představující disociaci jakékoli soli
c) Krok 3: Hydrolýza solí silných kyselin a zásad
Pro silnou kyselinu: když je anion soli kombinován s H+ vody za vzniku HCl, HBr, HI nebo jiné kyseliny, ve které je odečet počtu kyslíků od počtu vodíků roven nebo větší než 2, budeme mít
silná kyselina. Kombinace mezi uvedenými ionty tedy nenastává.Pro silný základ: když je kation soli patřící do rodin IA (alkalické kovy) nebo IIA (kovy alkalických zemin jiných než hořčík) kombinován s OH- vody, vytvoří a silný základ. Kombinace mezi uvedenými ionty tedy nenastává.
Když ionty soli neinteragují s ionty vody, máme následující rovnici:
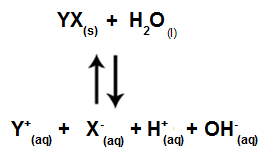
Rovnice zobrazující všechny ionty přítomné v roztoku
Stručně řečeno, jelikož solné ionty neinteragují s ionty vody, nepodporují solné ionty žádnou změnu v konečném roztoku. Můžeme tedy napsat rovnici hydrolýzy solí mezi silnými kyselinami a silnými zásadami jen pomocí rovnice ionizace vody.
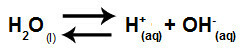
Rovnice představující hydrolýzu silných kyselin a zásad
d) Příklad hydrolýzy solí mezi silnými kyselinami a zásadami
Když přidáme chlorečnan draselný do vody (KClO3), sůl disociuje a uvolňuje draselný kation (K.+) a chlorečnanový anion (ClO3-) uprostřed.
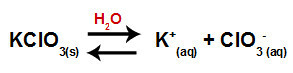
Disociační rovnice pro chlorečnan draselný
Je důležité si uvědomit, že voda prochází samoionizací a poskytuje médiu hydroniový kation (H+) a hydroxidový anion (OH-). Nyní musíme posoudit interakci mezi ionty soli a vody.
Když se H+ interaguje s ClO3-, tvoří kyselinu chloristou (HclO3). Protože odčítání počtu kyslíků od počtu ionizovatelných vodíků v kyselině chloristé je 2, je to silné. Interakce mezi ionty tedy nedochází.
Když K kation+ interaguje s OH aniontem-vznikne silná báze, protože draslík je alkalický kov. Interakce mezi ionty tedy nedochází.
Rovnice, která představuje hydrolýzu solí mezi silnými kyselinami a zásadami z rozpouštění chlorečnanu draselného ve vodě, je:
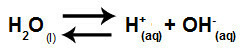
Chemická rovnice hydrolýzy chlorečnanu draselného
Podle mě. Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm