Základna je anorganická látka který podle švédského chemika Svante Arrheniuspokud je umístěn ve vodě, trpí fenoménem iontová disociace, ve kterém je vydání ionty: kation (Y+) a hydroxidový anion (OH-).

Obecný vzorec báze Arrhenius
skupina Y skupiny základna může to být jakýkoli kov nebo amoniová skupina (NH4+), které se uvolňují ve vodě jako kationty během disociace, jak je vidět na rovnici, která představuje proces:
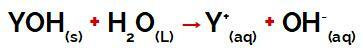
Rovnice představující disociaci báze
Níže uvádíme některé velmi důležité informace týkající se klasifikace a nomenklatury základny.
1) Klasifikace týkající se rozpustnost bází(schopnost rozpustit ve vodě)
Základny rozpustný: mají ve složení alkalický kov nebo amonium;
Základny málo rozpustný: mít kov alkalických zemin ve složení. Příklad: hydroxid hořečnatý, široce používaný jako antacidum a projímadlo;
základny prakticky nerozpustný: mít ve složení jakýkoli jiný kov. Příklad: hydroxid hlinitý, široce používaný jako antacidum.
2) Klasifikace týkající se místní síla(schopnost distancovat ve vodě)
Základny silný: mají ve složení alkalické kovy nebo kovy alkalických zemin, s výjimkou hořčíku;
Základny slabý: mít ve složení jakýkoli jiný kov.
3) Základní názvosloví
Chcete-li pojmenovat základnu, postupujte podle níže uvedeného pravidla pojmenování:
Hydroxid + de + název kovu nebo amonia
Příklad: Ca (OH)2 → hydroxid vápenatý
Pokud má báze chemický prvek, který nepatří do rodin IA, IIA nebo IIIA (a to není stříbro nebo zinek), musíme před název prvku uvést římskými číslicemi číslo hydroxylové skupiny:
Příklad: Ti (OH)4 → hydroxid titaničitý IV
Podle mě. Diogo Lopes
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm