Lorenzo Romano Amedeo Carlo Avogadro (1776-1856) byl italský chemik, který jako první vytvořil myšlenku, že vzorek prvku s hmotností v gramech numericky rovnou jeho atomové hmotnosti má vždy stejný počet atomů (N).
Avogadro sám nebyl schopen určit hodnotu N. V průběhu dvacátého století však pokrok v oblasti technologií a vědeckých poznatků umožňoval dalším vědcům vyvinout techniky k jejich určení. Když byla tato hodnota konečně objevena, byla volána Avogadrova konstanta, na počest tohoto vědce, protože to byl on, kdo položil základy jeho vzniku.

Lorenzo Romano Amedeo Carlo Avogadro (1776-1856)
V 1 molu jakékoli entity (atomy, molekuly, elektrony, vzorce nebo ionty) je obsažena přesně hodnota Avogadrovy konstanty.
Níže uvedená tabulka ukazuje některé hodnoty pro Avogadrovu konstantu získané během 20. století:
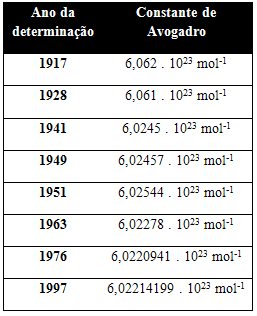
Zde jsou některé z technik použitých ke stanovení hodnoty Avogadrovy konstanty:
Prvním vědcem, který provedl přibližný výpočet Avogadrovy konstanty, byl Johann Joseph Loschmidt. V roce 1867 vycházel z kinetické teorie plynů a určoval, kolik molekul existuje v 1 cm3 plynu.
Dalším z těchto vědců byl Francouz Jean Baptiste Perrin (1870-1942), který spočítal počet koloidních částic na jednotku objemu v suspenzi a změřil jejich hmotnosti. Hodnota, kterou našel, byla mezi 6,5 a 7,2. 1023 entit na mol. Tento vědec vydal knihu v roce 1913 Les Atomes (1. vyd. Paris: Alcan) a jeho 9. vydání, vydané v roce 1924, obsahovalo 16 způsobů, jak experimentálně získat Avogadrovu konstantu.

Jean Baptiste Perrin (1870-1942)
O několik let později použil vědec James Dewar (1842-1923) metodu vyvinutou před lety radiochemikem Bertramem Boltwoodem (1870-1927) a fyzikem Ernestem Rutherford (1871-1937), který v zásadě spočíval v počítání alfa částic emitovaných radioaktivním zdrojem a v určování objemu získaného heliového plynu. Hodnota nalezená Dewarem byla 6,04. 1023 mol-1.
Ve 20. století provedl Robert Millikan (1868-1953) experiment ke stanovení náboje elektronu (1.6. 10-19 C). Protože náboj 1 molu elektronů byl již známý (96 500 C), bylo možné tyto dvě hodnoty spojit a najít pro Avogadrovu konstantu následující hodnotu: 6,03. 1023 mol-1.
V současné době je doporučená hodnota pro Avogadrovu konstantu 6,02214 x 1023 mol-1 a stanoví se pomocí rentgenové difrakce, při které se získá objem několika atomů krystalické mřížky, pokud je známa hustota a hmotnost 1 molu atomů ve vzorku.
Pro didaktické účely, na střední škole, kde výpočty nemusí být tak přesné jako výpočty prováděné v chemických laboratořích, se Avogadrova konstanta považuje za 6,02. 1023 mol-1.
Existují také jednodušší metody, které mohou studentům pomoci určit Avogadrovu konstantu v praxi. Jedním z nich je elektrolýza ve vodném prostředí.
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm
