Jak je vysvětleno v textu Reakce sčítání, tyto organické reakce se obvykle vyskytují se sloučeninami, které mají nenasycenost (dvojné vazby nebo trojice), ve kterém je vazba pí přerušena, což umožňuje vstup atomů nebo skupin atomů do řetězce. uhličitý.
K tomuto typu reakce však dochází také v případě cykloalkany (uzavřené řetězce uhlovodíků pouze s nasycenými (jednoduchými) vazbami mezi uhlíky), které mají tři nebo čtyři atomy uhlíku. Všimněte si níže uvedeného příkladu, kterým je bromace (halogenační reakce) cyklopropanu:
CH2
/ \ + br2 → br ─ CH2 ─ CH2 ─ CH2 ─ br
H2C CH2
Podobně existuje také adiční reakce zvaná hydrohalogenace nebo přidání halogenidu, jak je uvedeno níže:
CH2
/ \ + HBr → H ─ CH2 ─ CH2 ─ CH2 ─ br
H2C CH2
Všimněte si, že v obou případech byla molekula rozbitá a byly připraveny sloučeniny s otevřeným řetězcem.
Ale v cykloalkanech s pěti nebo více atomy uhlíku se to neděje tak snadno. Na druhou stranu je pravděpodobné, že tyto sloučeniny budou účinkovat substituční reakce, ve kterém vazba není přerušena, ale spíše je jeden nebo více atomů vodíku vázaných na uhlík nahrazeno atomy jiných prvků.
Cyklopentan může stále provádět adiční reakce, ale pouze při vyšších teplotách (kolem 300 ° C). V případě cyklohexanu je to velmi obtížné. Ve skutečnosti to jsou substituční reakce, jako je následující chlorace:
CH2 CH2
/ \ / \
H2C CH2 H2C CH ─ Cl
│ │ + Cl2→ │ │ + HCl
H2C CH2 H2C CH2
\ / \ /
CH2 CH2
Kruhy s pěti nebo více atomy uhlíku kromě reakcí nereagují s halogenovodíkovými kyselinami, jako je HBr.
Ale proč se to stalo? Proč cykloalkany se třemi nebo čtyřmi uhlíky provádějí adiční reakce a cykloalkany s více atomy uhlíku nemají tendenci?
Je to proto, že cyklopropan a cyklobutan jsou nestabilnější, takže je snazší rozbít jejich vazby.
Johann Friedrich Adolf von Bayer (1835-1917)
Aby to vysvětlil, vyvinul německý chemik Johann Friedrich Adolf von Bayer (1835-1917) v roce 1885 tzv. Teorie kruhového stresu, který to ukázal čtyři vazby vytvořené atomy uhlíku by byly stabilnější, kdyby měly úhel rovný 109 ° 28 ', jako je tomu v případě následujícího metanu:

Čtyři jednoduché vazby metanu mají úhel 109 ° 28 '
Toto je nejstabilnější úhel, protože odpovídá největší možné vzdálenosti mezi atomy v čtyřboké geometrii. S tím se elektronická repulze (odpuzování mezi elektrony ve valenčních vrstvách atomů) zmenšuje.
Cykloalkany se třemi, čtyřmi a pěti uhlíky mají vazebné úhly mezi uhlíky menší než 109 ° 28 '. Dívej se:
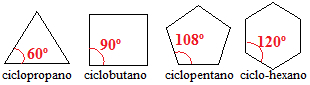
Úhly cykloalkanových vazeb
Na základě těchto skutečných úhlů, které můžeme obecně nazvat α, lze provést výpočet vazebného napětí pomocí následujícího vzorce:
napětí = 109º 28' - α
2
Víme, že cyklopropan je nejstabilnější a také nejreaktivnější cykloalkan, což potvrzuje výpočet napětí jeho kruhu ve srovnání s ostatními:
napětí cyklopropanu = 109º 28' – 60º = 109º – 60º + 28' = 49º + 28' = 24,5º + 14
2 2 2
Jako 0,5º = 30 pak máme:
napětí cyklopropanu = 24º + 30 '+ 14' = 24º 44'
cyklobutanové napětí = 109º 28' – 90º = 9º 44'2
cyklopentanové napětí = 109º 28' – 108º = 0º 44'2
Podle Bayerovy teorie napětí platí, že čím větší bude toto napětí, tím bude cyklón nestabilnější, tj. rozdíl mezi skutečným úhlem (α) a teoretickým úhlem (109 ° 28 '), nestabilnější a následně reaktivnější bude látka.
Proto je cyklopropan nejméně stabilní z cykloalkanů.
V Bayerově teorii však došlo k chybě, protože pokud budeme pokračovat v tomto výpočtu napětí pro cyklohexan, kde úhel připojení je 120 °, uvidíme, že hodnota bude ještě menší než u cyklopropanu, což se rovná -5 ° 16 '. To by poukazovalo na skutečnost, že cyklohexan by měl být ještě nestabilnější a provádět adiční reakce, což v praxi neplatí.
Vysvětlení této skutečnosti našel v roce 1890 německý chemik Hermann Sachse a v roce 1918 jej prokázal také německý chemik Ernst Mohr. Podle těchto vědců chyba v Bayerově teorii napětí v kruhu by spočívala ve skutečnosti, že se domníval, že všechny cykloalkany jsou koplanární, to znamená, že všechny jejich atomy uhlíku jsou v jedné rovině, com výkresy jejich struktur zobrazené výše.
Ve skutečnosti však kruhy cykloalkanů s více než pěti atomy uhlíku nejsou ploché, ale jejich atomy. získat prostorové konformace, které ruší napětí mezi spoji, vytvářející úhel 109 ° 28 'mezi Připojení.
Podívejme se například na případ cyklohexanu. Ve skutečnosti není plochý s úhlem 120 ° mezi jeho vazbami, ale ve skutečnosti se jeho atomy „točí“ a tvoří dvě možné konformace, „křeslo“ a „lodní“ konformace:
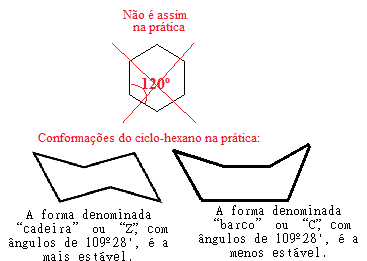
Možné konformace cyklohexanu v praxi
Všimněte si, že protože skutečný úhel cyklohexanu je roven 109 ° 28 ', jedná se o velmi stabilní sloučeninu, takže jeho molekula se nerozbije, a proto se neúčastní adičních reakcí. Všimněte si také, že tvar „židle“ je nejstabilnější, protože ve směsích vždy převládá protože v této konformaci jsou atomy vodíku vázané na uhlík dále od sebe. ostatní.
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/teoria-das-tensoes-dos-aneis-bayer.htm


