Když vaříme jídlo v našich domovech, používáme spalování kuchyňského plynu. Jednou z věcí, které můžeme vidět na plameni vznikajícím při spalování tohoto plynu, je to, že jeho barva je obvykle velmi světle modrá. Ve většině spalovacích reakcí, jako je spalování svíčky, je však plamen žlutý.

Pak vyvstává otázka:
„Pokud je každý oheň výsledkem spalovací reakce, proč mají některé plameny různé barvy?“
Abychom pochopili, jak k tomu dochází, musíme pochopit, co je to spalovací reakce a jaké látky jsou přítomny v každé ze zmíněných reakcí.
Spalovací reakce nastává, když je palivo (oxidovatelný materiál) spotřebováno okysličovadlem (plynný materiál obsahující kyslík) k výrobě tepelné energie (tepla).
Dalším důležitým bodem, který potřebujeme vědět o reakcích spalování, je to, že mohou probíhat v a úplné nebo neúplné. Pokud je k spotřebování paliva dostatek kyslíku, bude reakce úplná a vznikne oxid uhličitý (CO2) a voda (H2Ó). Jinak bude spalování částečné, neúplné a vznikne oxid uhelnatý (CO) a voda; nebo uhlík (C) a voda.
V obou případech analyzujeme, oxidačním činidlem je kyslík přítomný ve vzduchu. Paliva se však liší. Plyn na vaření je ve skutečnosti zkapalněný ropný plyn (LPG), což je směs uhlovodíků (alkanů), přičemž hlavním palivem je butan (C4H10). Plyn na vaření je tedy tvořen molekulami alkanu, které mají pouze tři nebo čtyři atomy uhlíku, proto je k úplnému spalování zapotřebí jen málo kyslíku. Tuto reakci lze vyjádřit následovně:
1C4H10 (g) + 13/2 O.2 (g) → 4 CO2 (g) + 5 hodin2Ó(G), ∆H <0
V případě svíček je parafin palivem pro reakci a je tvořen směsí alkanů s atomy uhlíku, které rozmezí od 20 do 36. Tím, k tomu, aby tato reakce proběhla plně, je zapotřebí mnohem více kyslíku. Viz příklad:
1C24H50 (s) + 70/2 O.2 (g) → 25 CO2 (g) + 25 hodin2Ó(G), ∆H <0
Ve vzduchu není dostatek kyslíku k provedení tohoto úplného spalování, takže probíhá neúplně, jak je znázorněno níže:
1C24H50 (s) +49/2 O2 (g) → 24 CO(G) + 25 hodin2Ó(G), ∆H <0
1C24H50 (s) +25/2 O.2 (g) → 24C(s) + 25 hodin2Ó(G), ∆H <0
Neúplné reakce produkují méně energie než úplné spalování. To vysvětluje rozdíl mezi barvami plamenů, protože žlutý plamen, charakteristický pro nedokonalé spalování, má nižší energii. Modrý plamen je charakteristický pro úplné spalování s větší energií.
To také vysvětluje tvorbu sazí plamenem svíčky (na obrázku níže), což je uhlík považovaný za produkt nedokonalého spalování.
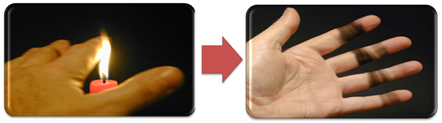
Ale proč je v Bunsenově hořáku možné dostat žlutý a modrý plamen, když se palivo nezmění?
V případě Bunsenova hořáku je toho dosaženo regulací přívodu plynu a vzduchu. Pokud je okno zavřené, což způsobí vstup malého množství vzduchu, získaný plamen bude žlutý, protože bude mít málo kyslíku k úplnému spalování. Pokud je regulace směsi plynu a vzduchu dostatečná, dostaneme modrý plamen.
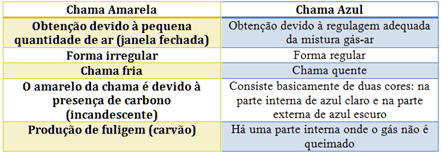
Charakteristiky každého z nich naleznete v následující tabulce:
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm
