Naučte se aplikovat první termodynamický zákon v různých situacích, řešte úlohy a otestujte si své znalosti na řešených a vysvětlených úlohách.
Otázka 1
První termodynamický zákon říká, že:
a) Energii nelze vytvořit ani zničit, ale lze ji přeměnit z jedné formy na druhou.
b) Energie se vždy zachovává, ale nelze ji přeměnit z jedné formy na druhou.
c) Energii lze vytvořit nebo zničit, ale nelze ji přeměnit z jedné formy na druhou.
d) Energii nelze uchovat, ale lze ji přeměnit z jedné formy do druhé.
První termodynamický zákon je princip zachování energie, tedy v systému zavřené, množství energie zůstává konstantní a může být transformováno pouze z jedné formy do druhé. jiný.
otázka 2
Předpokládejme uzavřený systém, který přijímá 100 J tepla a přitom vykonává 50 J práce. Jaká je změna vnitřní energie systému?
a) -50 J
b) 0 J
c) 50J
d) 100 J
e) 150 J
Kontrola značek:
Přijaté teplo je kladné Q > 0.
Odvedená práce je kladná W > 0.
Podle prvního zákona máme:
otázka 3
Ideální plynový systém vymění 500 joulů tepla s vnějším prostředím. Za předpokladu, že se jedná o izometrické chlazení, určete práci a vnitřní energii.
a) 500 J a 0 J
b) - 500 a 0 J
c) 0 J a 500 J
d) 0 J a - 500 J
e) -500 J a 500 J
Jelikož je proces izometrický, nedochází k žádné změně objemu, takže práce je nulová.
Podle prvního zákona termodynamiky:
Protože se jedná o chlazení, systém ztrácí teplo, proto:
otázka 4
8 molů ideálního plynu v systému píst-válec je stlačeno vykonáním 1000 J práce. Během procesu se do vnějšího prostředí ztratí 400 J tepla. Jeho vnitřní energie a změna jeho teploty se rovnají
Dáno: R = 8,31 J/mol. K
a) - 1400 J a přibližná variace 6 K
b) 600 J a přibližná variace 6 K
c) 600 J a přibližná změna 14 K
d) - 1400 J a přibližná odchylka 14 K
vnitřní energie
Jak systém přijímá práci, jeho znaménko je záporné, stejně jako teplo, které se při tomto procesu ztrácí.
První termodynamický zákon zní:
Dosazením hodnot dostaneme:
R = 8,31 J/mol K
Teplota
Podle Jouleova zákona máme:
otázka 5
Dokonalý plyn prochází kompresí a vykoná 500 J práce. Na konci této transformace se vnitřní energie systému změnila o 200 J méně než na začátku. Množství tepla vyměněného plynem bylo
a) - 700 J
b) - 300 J
c) 300 J
d) 0J
e) 700 J
Vzhledem k tomu, že práce byla přijata, tedy rezistentní práce, její znaménko je záporné.
Dosazením hodnot do rovnice prvního zákona termodynamiky:
otázka 6
(CEDERJ 2021) Ve fázi cyklu, kterou provádí ideální plyn v klimatizaci, se tlak plynu zvyšuje, přičemž se jeho objem udržuje konstantní. V této fázi cyklu je práce W, kterou plyn vykoná, množství tepla Q jím absorbovaného a změna ΔT jeho teploty, v tomto pořadí:
a) W < 0, Q < 0 a ΔT < 0
b) W = 0, Q > 0 a AT > 0
c) W = 0, Q = 0 a AT = 0
d) W > 0, Q > 0 a ΔT > 0
Data:
Tlak P se zvyšuje;
Objem zůstává konstantní;
Práce
Protože je objem konstantní, je práce W rovna nule.
První termodynamický zákon zní takto:
Protože teplo je pozitivní, změna vnitřní energie bude také pozitivní.
Teplo
Protože se teplo absorbuje, je to pozitivní.
Teplota
Podle zákona o plynu:
Kde,
n je počet molů
R je univerzální plynová konstanta
Teplota tedy závisí pouze na tlaku, protože objem je konstantní a je kladný.
otázka 7
(UNICENTRO 2018) Podle prvního zákona termodynamiky je změna vnitřní energie systému ΔU dáno rozdílem mezi výměnou tepla s vnějším prostředím Q a prací W vykonanou v procesu termodynamické. Pokud vezmeme v úvahu tuto informaci, pokud monatomický plyn expanduje tak, že má vždy stejnou teplotu, lze tuto transformaci znázornit rovnicí
a) ΔU + W = 0
b) ΔU − W =0
c) Q − W = 0
d) Q + ΔU = 0
Izotermický proces probíhá bez změny teploty.
Energie souvisí s teplotou:
Kde n je počet molů a R je univerzální plynová konstanta. Protože n a R jsou konstantní, existuje pouze změna teploty a
První termodynamický zákon zní takto:
otázka 8
(URCA 2016) Podle prvního termodynamického zákona, pokud během izotermického procesu, kterým prochází ideální plyn o pevné hmotnosti, plyn uvolňuje množství tepla, jehož velikost je 50 cal, pak změna vnitřní energie a práce, kterou plyn v tomto procesu vykoná, respektive:
a) 0 a 50 kal.
b) 50 cal a 0.
c) 0 a 0.
d) 50 cal a -50 cal.
e) 0 a -50 kal.
Změna vnitřní energie přímo souvisí se změnou teploty. Protože proces je izotermický, nedochází ke změně teploty .
Z prvního zákona termodynamiky:
Protože se uvolňuje teplo, jeho znaménko je záporné.
otázka 9
(UFRN 2012) Biomasa je jedním z hlavních zdrojů obnovitelné energie, a proto jsou stroje, které ji využívají jako palivo pro výrobu energie, důležité z hlediska životního prostředí. Velmi častým příkladem je využití biomasy k pohonu parní turbíny k výrobě práce. Obrázek na straně schematicky znázorňuje zjednodušenou termoelektrárnu.
V této termoelektrárně se spalováním biomasy v topeništi vyrábí teplo, které ohřívá vodu v kotli a vytváří vysokotlakou páru. Pára je zase vedena potrubím k turbíně, která při jejím působení začne otáčet lopatkami.
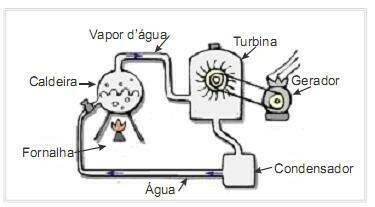
Tepelné ztráty v důsledku teplotních rozdílů mezi částmi tohoto tepelného stroje a okolím předpokládejte jako zanedbatelné. V této souvislosti kolísání vnitřní energie kotlové vody
a) je větší než součet tepla, které mu bylo dodáno spalováním biomasy a práce vykonané na turbíně.
b) se rovná součtu tepla dodaného do něj spalováním biomasy s prací vykonanou na turbíně.
c) se rovná rozdílu mezi teplem dodaným jí spalováním biomasy a prací vykonanou na turbíně.
d) je větší než rozdíl mezi teplem dodaným jí spalováním biomasy a prací vykonanou na turbíně.
Voda v kotli přijímá energii ve formě tepla ze spalování paliva a uvolňuje energii ve formě práce vykonané na turbíně.
otázka 10
(UECE 2021) Pokud jde o vlastnosti plynů, věnujte pozornost následujícím tvrzením:
i. U ideálního plynu je vnitřní energie funkcí pouze tlaku.
II. Teplo absorbované plynem při změně jeho skupenství je nezávislé na procesu.
III. Vnitřní energie ideálního plynu je funkcí pouze teploty a je nezávislá na procesu.
IV. Při izotermické expanzi ideálního plynu se práce, kterou vykoná, rovná absorbovanému teplu.
Je správné to, co je uvedeno pouze v
a) I a II.
b) III a IV.
c) I a IV.
d) II a III.
III. OPRAVIT. Vnitřní energie ideálního plynu je funkcí pouze teploty a je nezávislá na procesu.
Změna vnitřní energie přímo souvisí se změnou teploty.
Kde n je počet molů a R je ideální plynová konstanta, jsou konstanty, pouze teplota určuje vnitřní energii plynu.
IV. OPRAVIT. Při izotermické expanzi ideálního plynu se práce, kterou vykoná, rovná absorbovanému teplu.
Jelikož je izotermický, nedochází k žádné změně teploty, takže změna vnitřní energie je nulová. Podle prvního zákona termodynamiky:
Další informace:
- První zákon termodynamiky
- Termodynamika: zákony, pojmy, vzorce a cvičení
- Cvičení z termodynamiky
- plynový zákon
ASTH, Rafael. Cvičení prvního zákona termodynamiky.All Matter, [n.d.]. K dispozici v: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Přístup na:
Viz také
- Cvičení z termodynamiky
- Termodynamika
- adiabatická transformace
- Cvičení z termochemie
- První zákon termodynamiky
- Přírodní vědy a jejich technologie: Enem
- Termální energie
- Druhý zákon termodynamiky

