Mezi mezimolekulárními silami, indukované dipólem indukované dipólové síly jako jediné je nestudoval nizozemský fyzik Johannes Diederik Van der Waals (1837-1923). Objasnil je německý fyzik Fritz Wolfgang London (1900-1954), takže tyto síly jsou také tzv. londýnské síly nebo londýnské disperzní síly. Jiný název pro tyto síly je okamžitý dipól indukovaný dipól.
Tento druh síly se vyskytuje v nepolárních látekjako je H2, O2, F2, Cl2, C02, CH4 a C2H6, mimo jiné. A mohou se vyskytovat i mezi atomy vzácných plynů, když se přiblíží, což způsobí odpuzování mezi jejich elektrosférami. Tímto způsobem se elektrony hromadí na určité straně, která je záporně polarizována a na opačné straně kladně, v důsledku nedostatku záporného náboje.
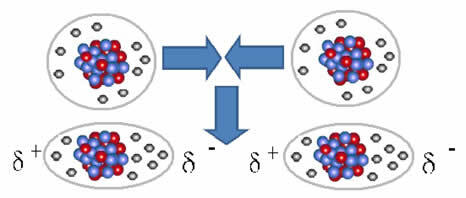
Nepolární molekuly mohou přejít z plynného skupenství – ve kterém jsou velmi daleko od sebe a nedochází k interakci, protože zde nejsou žádné póly – do kapalného a pevného skupenství. V těchto stavech agregace jsou molekuly blíže a elektronické přitahování nebo odpuzování mezi jejich elektrony a jádra mohou vést k deformaci jejich elektronových mraků, na okamžik, přičemž vzniknou kladné a záporné póly dočasný.
Okamžité dipóly mohou vyvolat polarizaci sousedních molekul, což má za následek přitažlivé síly.
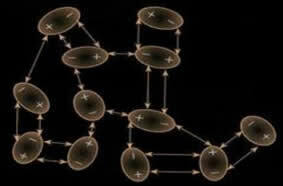
K této indukci může také dojít. mezi různými molekulami a obecně tyto síly jsou co do intenzity slabší než pevnost dipól-dipól a vodíková vazba. Proto pevné látky s touto interakční silou jako suchý led (oxid uhličitý - CO2) a jód (I2), které jsou v pevném skupenství, sublimují (přecházejí do plynného skupenství); protože energie potřebná k narušení jejich interakcí je malá.
Příklad mezimolekulárních sil mezi polárními a nepolárními molekulami nastává mezi plynným kyslíkem (nepolární) a vodou (polární). Ukazuje se, že záporný konec vody se přibližuje k O2, odpuzuje se a tím se elektronický mrak nepolární molekuly vzdaluje. Kyslík je poté na okamžik polarizován a začne interagovat s vodou a rozpustit se v ní.
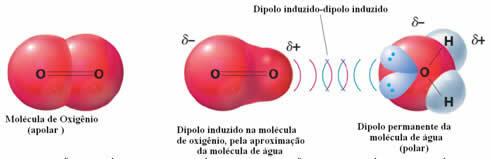
Protože tyto síly jsou slabé, rozpustnost tohoto plynu ve vodě je malá. I tak je jeho přítomnost nezbytná pro zachování života různých vodních organismů.
Tato interakční síla se vyskytuje také v přírodě a zajišťuje přilnavost mezi tlapkami gekonů a povrchem, po kterém chodí. Proto mohou chodit po stěnách a stropech, aniž by spadli nebo se přilepili.
Autor: Jennifer Fogaça
Vystudoval chemii
Brazilský školní tým
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/forcas-dipolo-induzido-dipolo-induzido-ou-dispersao-london.htm
