Oxidace je název pro proces ztráty elektronů atomem, skupinou nebo iontovým druhem během a chemická reakce. Pozná se z nárůstu v NOX (oxidační číslo) druhu nebo atomu při srovnání reaktantu a produktu.
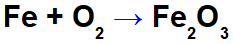
Rovnice oxidace železa.
Ve výše uvedené rovnici můžeme například uvést NOX každého z účastníků:
Činidlo železo (Fe): má NOX 0, protože je a jednoduchá látka;
Kyslík v činidle (O): má NOX 0, protože jde o jednoduchou látku;
Kyslík v produktu: má NOX -2, protože není spojen s alkalickým kovem, alkalické zeminy nebo tvorba vodíku peroxidy nebo superoxidy;
Železo v produktu: má NOX +3, protože součet NOX železa násobený 2 (počet atomů) + NOX kyslíku násobený 3 musí mít za následek 0, protože se jedná o složenou látku:
x, 2 + 3,(-2) = 0
2x - 6 = 0
2x = +6
x = + 6
2
x = +3
Při porovnání NOX reagenčního železa (0) s produktem (+3) jsme pozorovali nárůst, to znamená, že prošel procesem oxidace. Stojí za zmínku, že výskyt oxidace vždy je provázen jevem redukce (což znamená zisk elektronů), identifikovaným poklesem NOx, jak tomu je u kyslíku v příkladu.
Přečtěte si také:Stanovení oxidačního čísla (NOX)
Příklady situací, ve kterých dochází k oxidaci:
1. Spalování

Spalování materiálu také svědčí o oxidaci.
Spalování je každá chemická reakce, ke které dochází v přítomnosti a pohonné hmoty jakýkoli a oxidační kyslíkový plyn (O2), což vede k produkci tepla a světla. Při každé spalovací reakci dochází oxidace.
2. Některé organické reakce
V každé organické reakci, která probíhá v přítomnosti prostředků uvedených níže, je proces oxidace:
Dichroman draselný (K2Cr2Ó7) nebo manganistan draselný (KMnO4);
Přítomnost silné kyseliny nebo silné zásady;
Ozonový plyn (O3) v přítomnosti kovového zinku (Zn) a vody (H2Ó).
3. Baterie nebo baterie

Baterie jsou zařízení, ve kterých vždy dochází k oxidaci.
Hromady nebo baterie jsou elektrochemická zařízení, která uchovávají chemické látky. Jedna z těchto látek projde oxidací a druhá redukcí, což vede k produkci elektrického proudu.
4. Elektrolýza
Elektrolýza je chemický proces, při kterém je vodný roztok obsahující sůl vystaven elektrickému proudu, který nakonec podporuje oxidaci aniontů přítomných v těchto materiálech. V každé elektrolýze existuje oxidace.
Ode mě, Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-oxidacao.htm
