Mechanismus je simulací způsobu zpracování reakce, popisuje kroky, kterými reaktanty procházejí, aby dosáhly konečného produktu.
Mechanismy byly navrženy na základě experimentů, protože není možné vizualizovat krok za krokem reakce a jsou velmi užitečné v Organická chemie, protože organické sloučeniny mezi sebou reagují různými způsoby: lámáním vazeb, tvorbou sloučenin zprostředkovatelů.
Existují faktory, které ovlivňují výsledný produkt reakce, jako je například povaha rozpouštědla, polarita vazeb, výměna elektronů atd. Určitý mechanismus proto není vždy jedinou cestou pro vznik produktu, mohou se vyskytovat různými způsoby, například iontově nebo prostřednictvím volných radikálů.
1. iontový mechanismus: proces, který začíná heterolytickým přerušením kovalentní vazby a tvorbou iontů (karbokation a karbanion).
Sledujte mechanismus halogenace alkenů.
Mechanismus můžeme rozdělit do fází:
1. etapa: Heterolytické narušení kovalentní vazby (Cl — Cl): tvorba karbokationtu a aniontu (Cl-).
2. etapa: Útok chloridového aniontu (Cl-) na karbokation.
3. etapa: Tvorba produktu 1,2 - dichlorpropan.
Jak je vidět, k halogenaci alkenů dochází prostřednictvím iontového mechanismu.
Poznámka: Jak název napovídá, halogenace se provádí přidáním halogenu (chlóru) do molekuly.
2. Mechanismus prostřednictvím volných radikálů: homolytické roztržení kovalentní vazby tvoří volné radikály (velmi nestabilní a reaktivní), podívejme se na příklad:
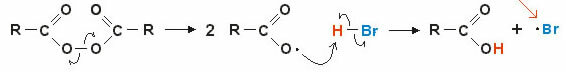
Reakce začíná rozbitím peroxidické vazby a tvorbou volných radikálů. V mezikroku dochází k radikálovému napadení polarizovaného vodíku (H — Br) a následné tvorbě nového volného radikálu • br (vysoce nestabilní a reaktivní).
Od Lírie Alvesové
Vystudoval chemii
Brazilský školní tým
Vidět víc!
Radikály v organické chemii
Organická chemie - Chemie - Brazilská škola
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/mecanismos-reacoes-organicas.htm

