Organická chemie je široká oblast chemie, která studuje sloučeniny uhlíku.
Ke znalostem organické chemie se přistupuje několika způsoby, a když jsme o tom přemýšleli, sestavili jsme pro vás navrhovaná cvičení, přijímací zkoušky a otázky Enem, abyste si ověřili své znalosti.
Pomocí komentářů k rezolucím se dozvíte o předmětu ještě více.
Navrhovaná cvičení
Otázka 1
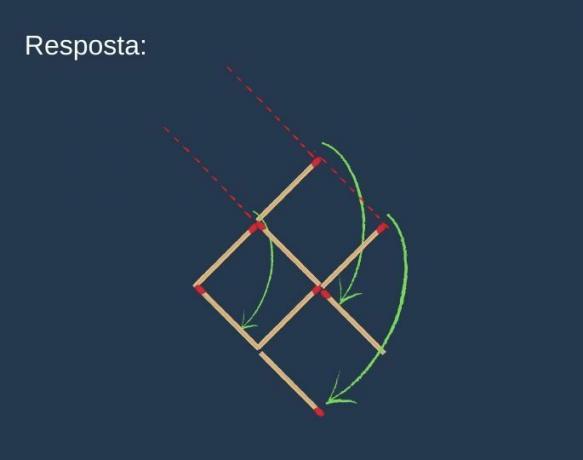
Podívejte se na níže uvedené organické sloučeniny a identifikujte organické funkce podle zvýrazněných funkčních skupin. Poté pojmenujte látky.
Odpověď:
a) Organická sloučenina: ethanol
- organická funkce: alkohol
- Obecný vzorec: R — OH
- Identifikace: hydroxyl (OH) navázaný na uhlíkový řetězec
b) Organická sloučenina: kyselina ethanová.
- Organická funkce: karboxylová kyselina
- Obecný vzorec: R — COOH
- Identifikace: karboxylový radikál (COOH) navázaný na uhlíkový řetězec
c) Organická sloučenina: trimethylamin
- Organická funkce: amin (terciární)
- Obecný vzorec:
- Identifikace: dusík vázaný na tři uhlíkové řetězce
otázka 2
V organické chemii jsou sloučeniny rozpoznávány řetězci tvořenými uhlíkem a vodíkem. Součástí chemické struktury těchto sloučenin však mohou být i jiné prvky, například kyslík.
Vyberte alternativu, kde obě organické sloučeniny mají okysličené organické funkce.
a) chloroform a ethylmethanát
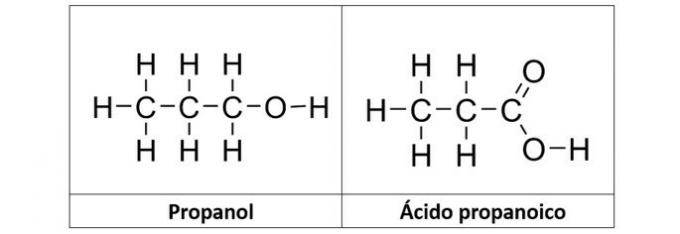
b) propanol a kyselina propanová
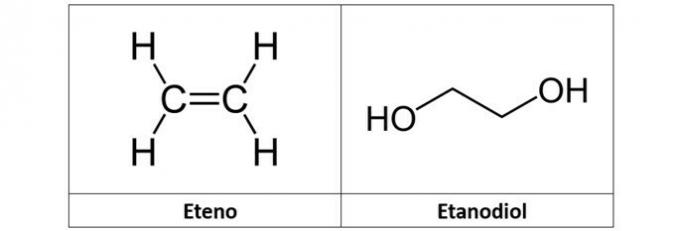
c) ethen a etandiol
d) ethanamid a benzen
Správná odpověď: b) propanol a kyselina propanová
a) NESPRÁVNÉ. Máme chloroform (CHCI3), což je alkylhalogenid, a ethylmethanoátový ester (C.3H6Ó2), který ve své struktuře obsahuje kyslík.
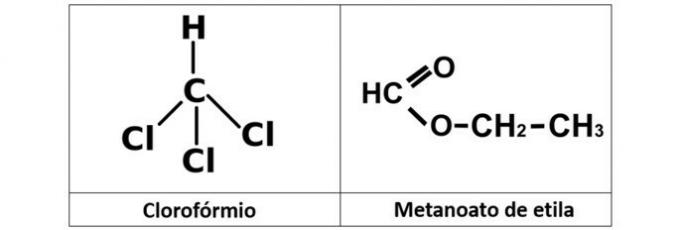
b) SPRÁVNĚ. V této alternativě máme dvě sloučeniny, které mají okysličené organické funkce. Propanol (C.3H8O) je alkohol tvořený třemi uhlíky. Kyselina propanová (C3H6Ó2) je karboxylová kyselina.
c) NESPRÁVNÉ. Ethylen (C2H4), nazývaný také ethylen, je uhlovodík alkenového typu. Již etandiol (C.2H6Ó2) je alkohol, který má ve své struktuře dva hydroxyly.
d) NESPRÁVNÉ. Ethanamid (C.2H5NO) je amid a benzen je aromatický uhlovodík, a proto je tvořen pouze uhlíkem a vodíkem.

otázka 3
Podívejte se na strukturu organické sloučeniny níže a zkontrolujte pravdivá tvrzení.

(01) Sloučenina má funkci organického dusíku.
(02) Je to primární amin, protože je vázán pouze na jeden vodík.
(03) Název sloučeniny je diethylamin.
Správná odpověď:
(01) SPRÁVNĚ. Dusíkatou organickou funkcí přítomnou ve sloučenině je amin.
(02) NESPRÁVNÉ. Jedná se o sekundární amin, protože dusík je spojen se dvěma uhlíkovými řetězci.
(03) NESPRÁVNÉ. Název sloučeniny je dimethylamin, protože k dusíku jsou připojeny dva methylové radikály.
otázka 4
Eugenol, člen rodiny fenylpropanoidů, je aromatická organická sloučenina přítomná v hřebíčku, koření používaném od starověku.

Sledujte strukturní vzorec sloučeniny a identifikujte přítomné organické funkce.
a) Alkohol a ether
b) Fenol a ether
c) Alkohol a ester
d) Fenol a ester
e) Alkohol a uhlovodíky
Správná alternativa: b) Fenol a ether.
Eugenol má ve svém řetězci okysličené organické funkce, to znamená, že kromě atomů uhlíku a vodíku je kyslík přítomný heteroatom.
Fenolová organická funkce je charakterizována hydroxylem (-OH) připojeným k aromatickému kruhu. Ve funkci etheru je kyslík umístěn mezi dvěma uhlíkovými řetězci.
otázka 5
EDTA, jehož celé jméno je kyselina ethylendiamintetraoctová, je organická sloučenina s mnoha aplikacemi. Díky své schopnosti vázat kovové ionty z něj dělá chelatační činidlo široce používané v laboratoři i v průmyslu.
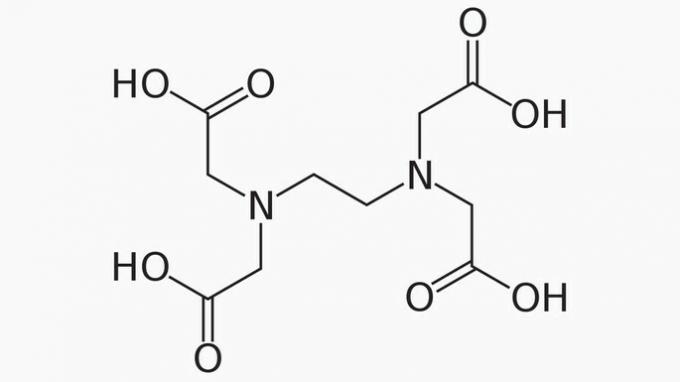
O EDTA je správné říci, že uhlíkový řetězec je:
a) Otevřený, homogenní a nenasycený.
b) Uzavřený, heterogenní a nasycený.
c) Otevřený, heterogenní a nenasycený.
d) Uzavřené, homogenní a nasycené.
e) Otevřený, heterogenní a nasycený.
Správná odpověď: e) Otevřená, heterogenní a nasycená.
Řetězec EDTA je klasifikován do:
OTEVŘENO. Podle uspořádání atomů uhlíku ve struktuře EDTA vidíme, že v důsledku přítomnosti konců je otevřen řetězec sloučeniny.
HETEROGENNÍ. Kromě sloučenin uhlíku a vodíku má uhlíkový řetězec heteroatomy dusíku a kyslíku.
NASYCENÝ. Vazby mezi atomy uhlíku jsou nasycené, protože řetězec má pouze jednoduché vazby.
Více se dozvíte na: Organická chemie.
otázky přijímací zkoušky
Otázka 1
(UFSC) Sledujte neúplné organické struktury a určete správné položky:
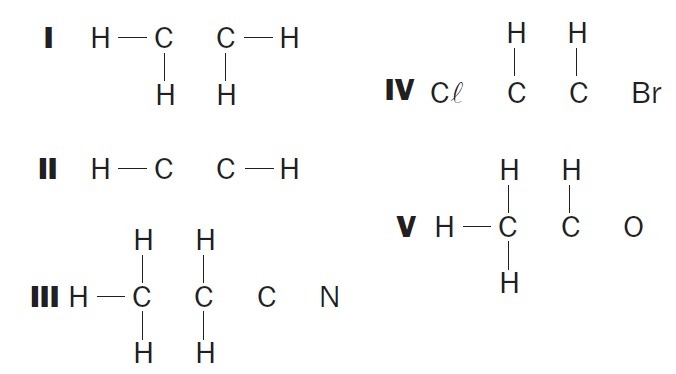
(01) Struktuře I chybí jednoduchá vazba mezi atomy uhlíku.
(02) Struktuře II chybí trojná vazba mezi atomy uhlíku.
(03) Struktuře III chybí dvě jednoduché vazby mezi atomy uhlíku a trojná vazba mezi atomy uhlíku a dusíku.
(04) Struktura IV postrádá dvě jednoduché vazby mezi atomy uhlíku a halogeny a dvojnou vazbu mezi atomy uhlíku.
(05) Struktuře V chybí jednoduchá vazba mezi atomy uhlíku a jednoduchá vazba mezi atomy uhlíku a kyslíku.
Správné alternativy: 02, 03 a 04.
Kromě uhlíku, povinného chemického prvku v organických sloučeninách, mohou být ve strukturách přítomny další prvky a vázané kovalentními vazbami, kde jsou sdíleny elektrony.
Valence prvků určuje počet vazeb, které lze vytvořit, jak ukazuje následující tabulka.
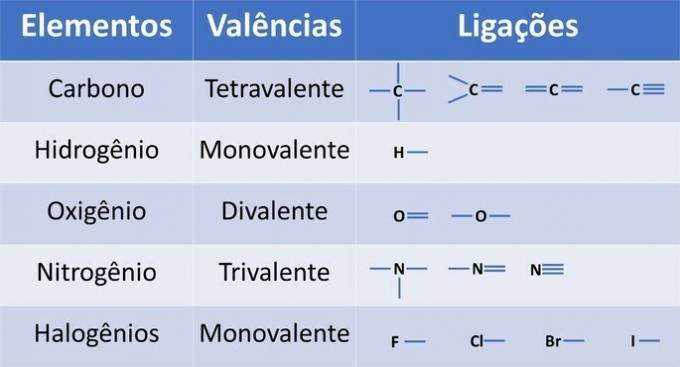
Z těchto informací máme:
(01) ŠPATNÉ. Struktura postrádá dvojnou vazbu mezi atomy uhlíku za vzniku ethenové sloučeniny.
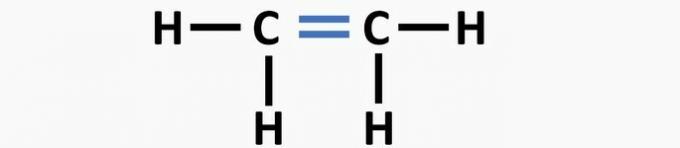
(02) SPRÁVNĚ. Struktura postrádá trojnou vazbu mezi atomy uhlíku za vzniku ethynové sloučeniny.
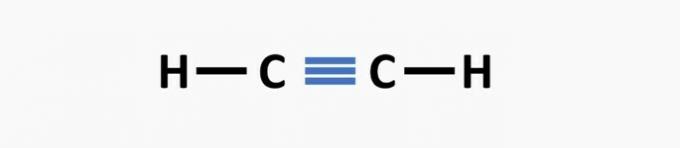
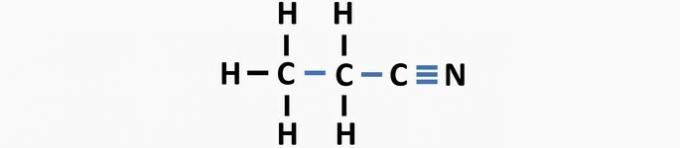
(03) SPRÁVNĚ. Struktura postrádá jednoduché vazby mezi uhlíky a trojné vazby mezi uhlíkem a dusíkem za vzniku sloučeniny propannitrilu.
(04) SPRÁVNĚ. Struktura postrádá jednoduché vazby mezi uhlíkem a halogenem a dvojné vazby mezi uhlíky za vzniku dichlorethenové sloučeniny.
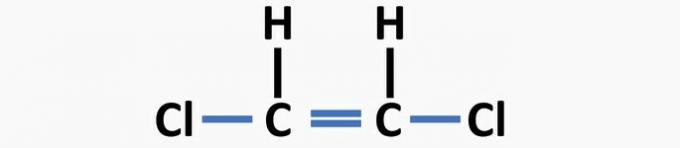
(05) ŠPATNÉ. Struktura postrádá jednoduchou vazbu mezi uhlíky a dvojnou vazbu mezi uhlíkem a kyslíkem za vzniku ethanal sloučeniny.
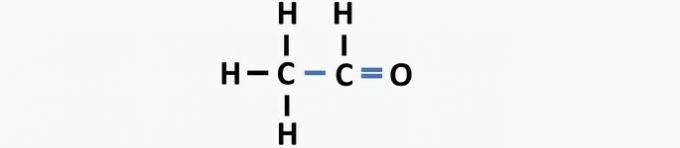
otázka 2
(UFPB) Struktura organické sloučeniny molekulárního vzorce C5H8Rozvětvený, nenasycený, heterogenní a alicyklický řetězec představuje:

Správná alternativa: d.
Uhlíkové řetězy lze klasifikovat následovně:
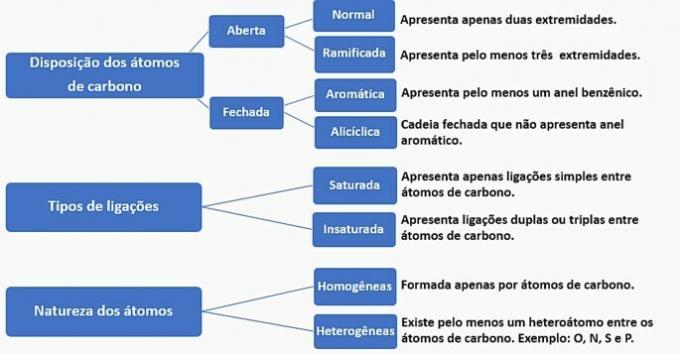
Podle těchto informací máme:
a) NESPRÁVNÉ. Řetěz je klasifikován jako normální, nasycený, homogenní a alicyklický.
b) NESPRÁVNÉ. Řetěz je klasifikován jako normální, nenasycený, homogenní a otevřený.
c) NESPRÁVNÉ. Řetěz je klasifikován jako rozvětvený, nenasycený, homogenní a otevřený.
d) SPRÁVNĚ. Řetěz je klasifikován jako rozvětvený, nenasycený, heterogenní a alicyklický
- Má větev: methylový radikál;
- Má nenasycenost: dvojná vazba mezi uhlíky;
- Má heteroatom: kyslík navázaný na dva uhlíky;
- Představuje uzavřený řetězec: uhlíky spojené v kruhu bez přítomnosti aromatického kruhu.
e) NESPRÁVNÉ. Řetěz je klasifikován jako rozvětvený, nenasycený, heterogenní a otevřený.
otázka 3
(Centec-BA) Ve struktuře zobrazené níže jsou číslované uhlíky:
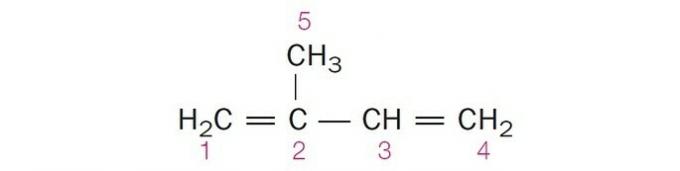
a) sp2, sp, sp2, sp2, sp3.
b) sp, sp3, sp2, sp, sp4.
c) sp2, sp2, sp2, sp2, sp3.
d) sp2, sp, sp, sp2, sp3.
e) sp3, sp, sp2, sp3, sp4.
Správná alternativa: c) sp2, sp2, sp2, sp2, sp3.
Vzhledem k tomu, že má 4 elektrony ve valenčním plášti, je uhlík čtyřmocný, to znamená, že má tendenci vytvářet 4 kovalentní vazby. Tyto vazby mohou být jednoduché, dvojité nebo trojité.
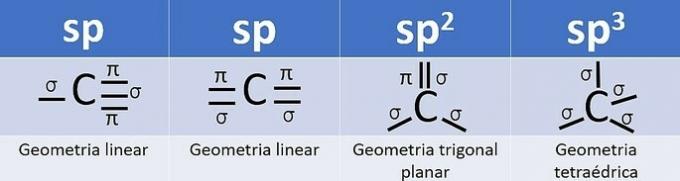
Počet hybridních orbitalů je součtem sigma vazeb (σ) uhlíku, protože vazba nehybridizuje.
- sp: 2 sigma odkazy
- sp2: 3 sigma odkazy
- sp3: 4 sigma odkazy
Podle těchto informací máme:
a) NESPRÁVNÉ. Uhlík 2 má sp hybridizaci2, protože má 3 vazby σ a jednu vazbu .
b) NESPRÁVNÉ. Uhlík nemá hybridizaci sp4 a hybridizace sp nastává, když mezi uhlíky existuje trojná vazba nebo dvě dvojné vazby.
c) SPRÁVNĚ. Součet vazeb σ na každém uhlíku poskytuje alternativní hybridizaci.
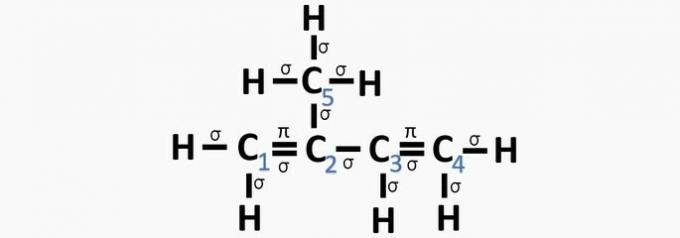
d) NESPRÁVNÉ. Sp hybridizace nastává, když mezi uhlíky existuje trojná vazba nebo dvě dvojné vazby.
e) NESPRÁVNÉ. Uhlík nemá hybridizaci sp4 a hybridizace sp nastává, když mezi uhlíky existuje trojná vazba nebo dvě dvojné vazby.
otázka 4
(UFF) Existuje plynný vzorek tvořený jednou z následujících sloučenin: CH4; C2H4; C2H6; C3H6 nebo C.3H8. Pokud 22 g tohoto vzorku zaujímá objem 24,6 l při tlaku 0,5 atm a teplotě 27 ° C (zadáno: R = 0,082 l .atm. K.–1.mol–1), došlo se k závěru, že se jedná o plyn:
a) ethan.
b) metan.
c) propan.
d) propylen.
e) eten.
Správná alternativa: c) propan.
1. krok: převeďte jednotku teploty z Celsia na Kelvina.
2. krok: výpočet počtu molů sloučeniny pomocí obecné rovnice plynu.
3. krok: vypočítá molární hmotnost sloučeniny.
4. krok: Najděte uhlovodík, který má molární hmotnost 44 g / mol.
Metan
Ethene
Etan
propylen
Propan
Proto se dospělo k závěru, že plyn, který odpovídá informacím v prohlášení, je propan.
otázka 5
(ITA) Zvažte následující látky:
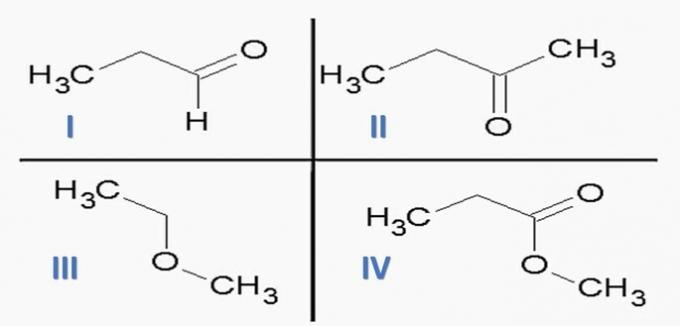
a následující chemické funkce:
The. karboxylová kyselina;
B. alkohol;
C. aldehyd;
d. keton;
a. ester;
F. éter.
Možnost, která SPRÁVNĚ spojuje látky s chemickými funkcemi, je:
a) Id; IIc; IIIe; IVf.
b) Ic; IId; IIIe; káď
c) Ic; IId; IIIf; IVe.
dělal; IIc; IIIf; IVe.
e) Ia; IIc; IIIe; IVd.
Správná alternativa: c) Ic; IId; IIIf; IVe.
Organické funkce jsou určovány strukturami a skupinovými organickými sloučeninami s podobnými vlastnostmi.
Chemické funkce přítomné v alternativách jsou:
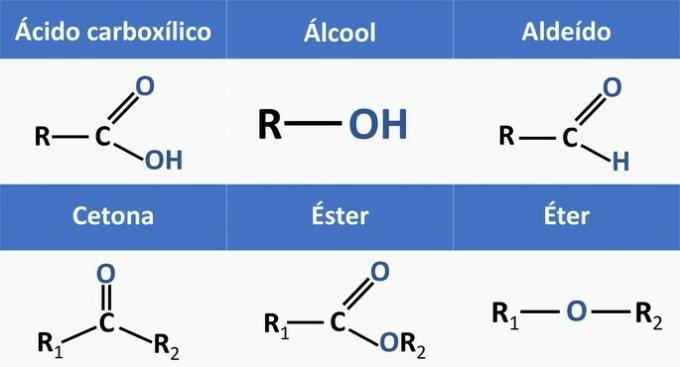
Analýzou výše uvedených struktur a sloučenin přítomných v prohlášení máme:
a) NESPRÁVNÉ. Funkce orgánů jsou správné, ale pořadí je špatné.
b) NESPRÁVNÉ. Mezi sloučeninami není žádná karboxylová kyselina.
c) SPRÁVNĚ. Funkční skupiny přítomné ve sloučeninách představují následující chemické funkce.

d) NESPRÁVNÉ. I je aldehyd a II je keton.
e) NESPRÁVNÉ. Mezi sloučeninami není žádná karboxylová kyselina.
Více se dozvíte na: Organické funkce.
Enemové otázky
Otázka 1
(Enem / 2014) Jedna metoda pro stanovení obsahu ethanolu v benzínu spočívá ve smíchání známých objemů vody a benzínu v konkrétní lahvi. Po protřepání baňky a čekání po určitou dobu se změří objem dvou nemísitelných fází, které se získají: jedné organické a druhé vodné. Ethanol, kdysi mísitelný s benzínem, je nyní mísitelný s vodou.
Je třeba vědět, jak vysvětlit chování ethanolu před a po přidání vody
a) hustota kapalin.
b) velikost molekul.
c) bod varu kapalin.
d) atomy přítomné v molekulách.
e) typ interakce mezi molekulami.
Správná alternativa: e) typ interakce mezi molekulami.
Mezimolekulární síly ovlivňují rozpustnost organických sloučenin. Látky mají tendenci se navzájem rozpouštět, pokud mají stejnou mezimolekulární sílu.
V tabulce níže najdete několik příkladů organických funkcí a typ interakce mezi molekulami.
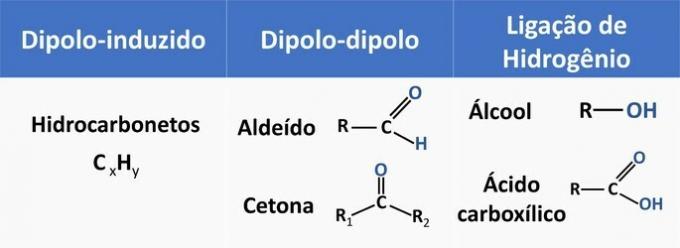
Ethanol je považován za polární rozpouštědlo, protože má ve své struktuře polární skupinu (—OH). Jeho uhlíkový řetězec, který je nepolární (CH), je však schopen interagovat s nepolárními rozpouštědly. Proto se ethanol solubilizuje jak ve vodě, tak v benzínu.
Podle těchto informací máme:
a) NESPRÁVNÉ. Hustota souvisí s hmotou těla a obsazeným objemem.
b) NESPRÁVNÉ. Velikost molekul ovlivňuje polaritu sloučenin: čím větší je uhlíkový řetězec, tím více je látka nepolární.
c) NESPRÁVNÉ. Bod varu je užitečný pro separaci molekul: destilace odděluje sloučeniny s různými teplotami varu. Čím nižší je bod varu, tím snadněji se molekula odpaří.
d) NESPRÁVNÉ. Aldehyd má ve své struktuře uhlík, vodík a kyslík. Tato sloučenina provádí interakce dipól-dipól, zatímco alkohol, který má stejné prvky, je schopen vytvářet vodíkové vazby.
e) SPRÁVNĚ. Interakce ethanolu s vodou (vodíková vazba) je intenzivnější než s benzínem (indukovaným diplozem).
otázka 2
(Enem / 2013) Molekuly nanoputians připomínají lidské postavy a byly vytvořeny, aby stimulovaly zájem mladých lidí o porozumění jazyku vyjádřenému ve strukturních vzorcích, široce používaných v organické chemii. Příkladem je NanoKid, znázorněný na obrázku:
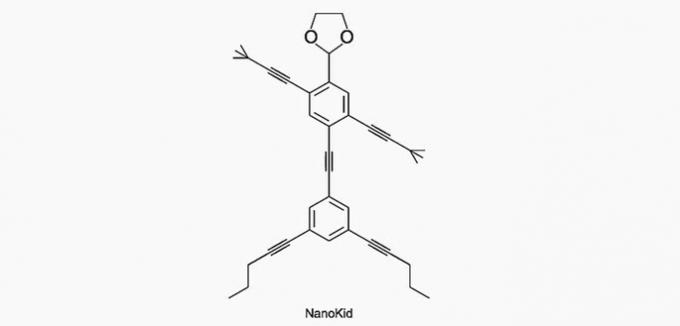
Kde v těle NanoKidu je kvartérní uhlík?
a) Ruce.
b) Hlava.
c) Hrudník.
d) Břicho.
e) Nohy.
Správná alternativa: a) Ruce.
Uhlík je klasifikován následovně:
- Primární: váže se na uhlík;
- Sekundární: váže se na dva uhlíky;
- Terciární: váže se na tři uhlíky;
- Kvartér: váže se na čtyři uhlíky.
Viz příklady níže.

Podle těchto informací máme:
a) SPRÁVNĚ. Uhlík v ruce je spojen se čtyřmi dalšími uhlíky, takže je kvartérní.
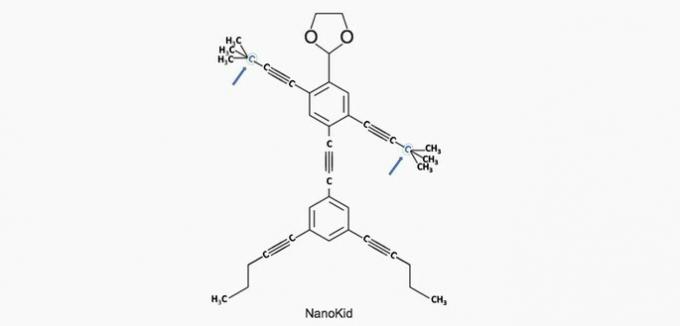
b) NESPRÁVNÉ. Hlava je složena z primárních uhlíků.
c) NESPRÁVNÉ. Hrudník je tvořen sekundárními a terciárními uhlíky.
d) NESPRÁVNÉ. Břicho je tvořeno sekundárními uhlíky.
e) NESPRÁVNÉ. Nohy jsou tvořeny primárními uhlíky.
otázka 3
(Enem / 2014) Některé polymerní materiály nelze použít k výrobě určitých typů artefaktů, a to ani pro omezení mechanických vlastností, a to buď snadností, s jakou jsou vystaveni degradaci, a vytvářejí k tomu nežádoucí vedlejší produkty aplikace. Proto se stává důležitou kontrola, aby se určila povaha polymeru použitého při výrobě artefaktu. Jedna z možných metod je založena na rozkladu polymeru za vzniku monomerů, které k němu vedly.
Řízený rozklad artefaktu generovaného diaminu H2N (CH2)6NH2 a HO dikyselina2C (CH2)4CO2H. Proto byl artefakt vyroben z
a) polyester.
b) polyamid.
c) polyethylen.
d) polyakrylát.
e) polypropylen.
Správná alternativa: b) polyamid.
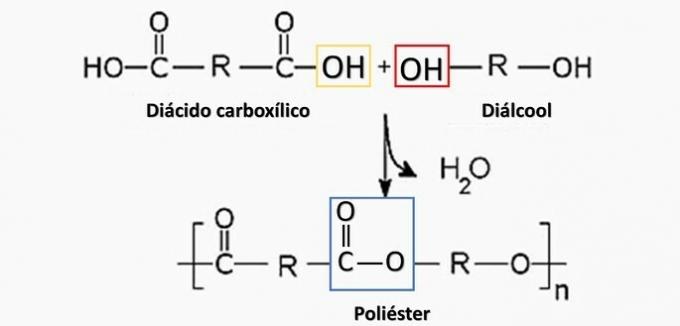
a) NESPRÁVNÉ. Polyester se tvoří při reakci mezi dikarboxylovou kyselinou (—COOH) a dialkoholem (—OH).
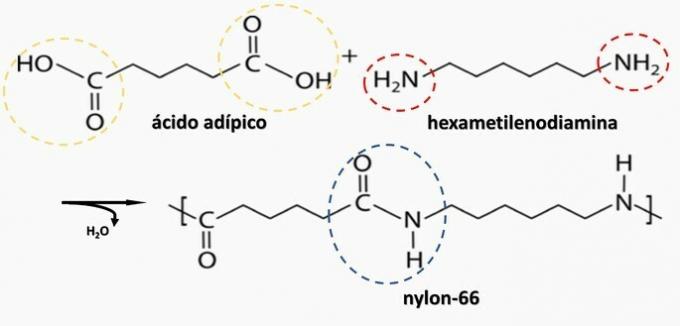
b) SPRÁVNĚ. Polyamid vzniká polymerací dikarboxylové kyseliny (—COOH) s diaminem (—NH2).
c) NESPRÁVNÉ. Polyethylen se tvoří při polymeraci ethylenového monomeru.
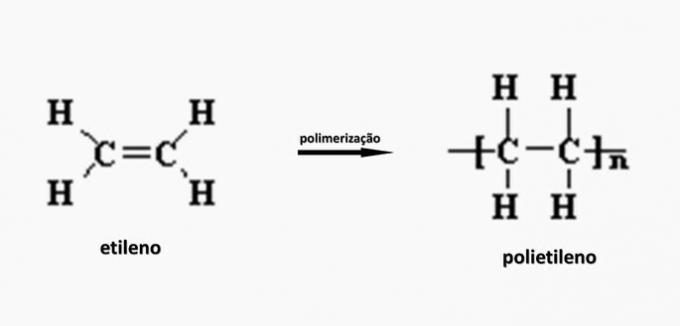
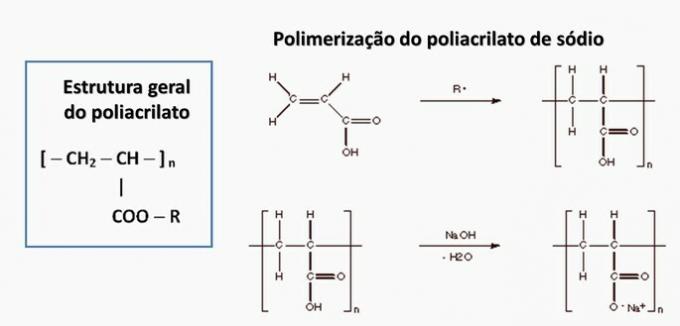
d) NESPRÁVNÉ. Polyakrylát je tvořen solí odvozenou od karboxylové kyseliny.
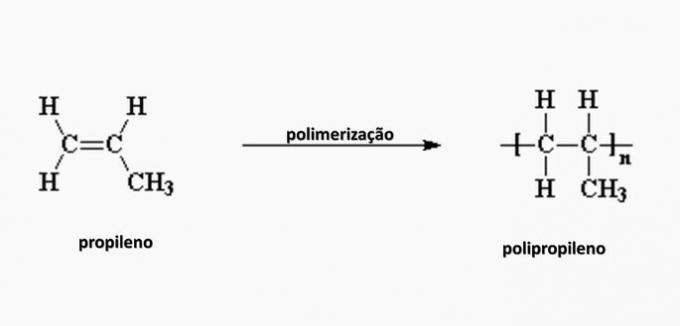
e) NESPRÁVNÉ. Polypropylen vzniká polymerací propylenového monomeru.
otázka 4
(Enem / 2008) Čína se zavázala odškodnit Rusko za únik benzenu z průmyslového odvětví Čínská petrochemie v řece Songhua, přítoku řeky Amur, která tvoří součást hranice mezi těmito dvěma zemí. Prezident Ruské federální agentury pro vodní zdroje ujistil, že benzen se nedostane do ropovodů pitnou vodu, ale požádal obyvatele, aby vařili tekoucí vodu a vyhýbali se rybolovu v řece Amur a jejím okolí přítoky. Místní orgány skladují stovky tun uhlí, protože minerál je považován za účinný absorbér benzenu. Internet: (s úpravami). S ohledem na opatření přijatá k minimalizaci škod na životním prostředí a obyvatelstvu je správné to konstatovat
a) uhlí, když je umístěno do vody, reaguje s benzenem a vylučuje ho.
b) benzen je těkavější než voda, a proto je třeba ho vařit.
c) orientace, jak se vyhnout rybolovu, je způsobena potřebou konzervování ryb.
d) benzen by nekontaminoval potrubí pitné vody, protože by byl přirozeně dekantován na dně řeky.
e) znečištění způsobené únikem benzenu čínským průmyslem by bylo omezeno na řeku Songhua.
Správná alternativa: b) benzen je těkavější než voda, a proto je nutné ho vařit.
a) NESPRÁVNÉ. Uhlí obsahuje ve své struktuře několik pórů a používá se jako adsorbent, protože je schopné interagovat s kontaminujícími látkami a zadržovat je na svém povrchu, ale ne eliminovat je.
b) SPRÁVNĚ. Čím větší je těkavost látky, tím snadněji se mění v plynný stav. Zatímco teplota varu vody je 100 ° C, teplota benzenu je 80,1 ° C. Je to proto, že voda je polární sloučenina a benzen je nepolární sloučenina.
Typ interakcí, které molekuly vytvářejí, se liší a ovlivňují také teplotu varu látek. Molekula vody je schopna vytvářet vodíkové vazby, což je druh interakce mnohem silnější než interakce, které je schopen vytvořit benzen s indukovaným dipólem.
c) NESPRÁVNÉ. V potravinovém řetězci se jedna bytost stává potravou jiné podle interakcí druhů v dané lokalitě. Když se toxická látka uvolní do životního prostředí, dochází k postupnému hromadění a rybám kontaminovaný, při požití člověkem, může vzít benzen s sebou a způsobit mutace DNA a dokonce dokonce rakovina.
d) NESPRÁVNÉ. Benzen má nižší hustotu než voda. Trendem tedy je, že i pod vodou se nadále šíří.
e) NESPRÁVNÉ. Sezónní změny mohou problém dále zvětšit, protože nízké teploty snižují kapacitu biologického rozkladu chemických látek působením slunce nebo bakterií.
otázka 5
(Enem / 2019) Uhlovodíky jsou organické molekuly s řadou průmyslových aplikací. Například jsou přítomny ve velkém množství v různých ropných frakcích a jsou obvykle odděleny frakční destilací na základě jejich teploty varu. Tabulka ukazuje hlavní frakce získané z destilace oleje při různých teplotních rozsazích.
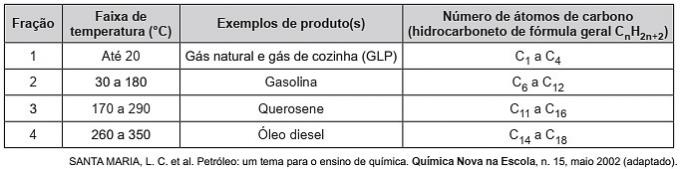
Ve frakci 4 dochází k separaci sloučenin při vyšších teplotách, protože
a) jejich hustoty jsou větší.
b) počet poboček je větší.
c) jeho rozpustnost v oleji je větší.
d) mezimolekulární síly jsou intenzivnější.
e) uhlíkový řetězec je těžší prolomit.
Správná alternativa: d) mezimolekulární síly jsou intenzivnější.
Uhlovodíky interagují indukovaným dipólem a tento typ mezimolekulární síly se zesiluje s nárůstem uhlíkového řetězce.
Proto mají těžší ropné frakce vyšší teplotu varu, protože řetězce silněji interagují indukovaným dipólem.
Další cvičení s komentovaným rozlišením najdete také:
- Cvičení na uhlovodíky
- Cvičení na organické funkce
- Chemické otázky v Enem