Uhlovodíky jsou sloučeniny tvořené pouze uhlíkem a vodíkem, s obecným vzorcem: CXHy.
Jedná se o velké množství látek, z nichž nejznámější jsou složky ropy a zemního plynu.
Páteř uhlovodíku je tvořena uhlíkem a atomy vodíku se zase váží kovalentní vazbou.
Jsou široce používány v chemickém průmyslu a jsou zásadní při výrobě ropných derivátů: paliva, polymery, parafiny, mimo jiné.
Vlastnosti uhlovodíků
| molekulární interakce | Jsou to prakticky nepolární sloučeniny a jejich molekuly jsou spojeny indukovaným dipólem. |
|---|---|
| Bod tání a bod varu | Ve srovnání s polárními sloučeninami jsou nízké. |
| stavy agregace |
|
| Hustota | Mají nižší hustotu než voda. |
| Rozpustnost | Jsou nerozpustné ve vodě a rozpustné v nepolárních látkách. |
| Reaktivita |
|
Klasifikace uhlovodíků
Pokud jde o formu hlavního uhlíkového řetězce, uhlovodíky se dělí na:
alifatické uhlovodíky
Tvoří je otevřené nebo acyklické uhlíkové řetězce, které mají koncové uhlíky.
- alkany
- alkeny
- Alkyny
- Alkadienes
Příklad:
Podívejte se taky: uhlíkové řetězce
Cyklické uhlovodíky
Tvoří je uzavřené nebo cyklické uhlíkové řetězce, které nemají koncové uhlíky.
- Cyclans
- Cykly
- cyklisté
- Aromatika
Příklady:
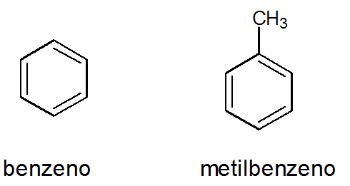
Podívejte se taky: benzen
Pokud jde o vazby uhlíkových řetězců, ať už jednoduché, dvojité nebo trojité:
Nasycené uhlovodíky
Sloučeniny jsou tvořeny jednoduchými vazbami mezi atomy uhlíku a vodíku.
- alkany
- Cyclans
Příklad:
nenasycené uhlovodíky
Vytvořené sloučeniny mají dvojné nebo trojné vazby mezi atomy uhlíku a vodíku.
- alkeny
- Alkyny
- Alkadienes
- Cykly
- cyklisté
- Aromatika
Přečtěte si také o:
- Chemické vazby
- Organická chemie
- Organické funkce
Nomenklatura
Názvosloví uhlovodíků je definováno následujícími pojmy:
| PŘEDPONA | ZPROSTŘEDKOVATEL | PŘÍPONA |
|---|---|---|
| Udává počet uhlíků přítomných v řetězci. | Typ odkazu nalezeného v řetězci. | Identifikace funkční skupiny. |
| PŘEDPONA | ZPROSTŘEDKOVATEL | PŘÍPONA | ||
|---|---|---|---|---|
| 1C | SE SETKAL | Pouze jeden odkaz | AN | Ó |
| 2C | ET | |||
| 3C | PODPĚRA | dvojná vazba | EN | |
| 4C | ALE | |||
| 5C | PENT | dvě dvojné vazby | DIEN | |
| 6C | ŠEST | |||
| 7C | HEPT | trojitý odkaz | V |
|
| 8C | ŘÍJEN | |||
| 9C | NE | Dva trojité odkazy | DIIN | |
| 10C | DEC |
Příklady
Sledujte, jak se tvoří názvy uhlovodíků:
| Etan |
- Předpona: ET, což odpovídá 2 uhlíkům.
- Zprostředkovatel: AN, což odpovídá jednotlivým odkazům.
- Přípona: Ó, což odpovídá uhlovodíkové funkci.
Podívejte se na další příklady:
| Propan | |
| Ethene | |
| Etino | |
| propadien |
V některých případech je nutné označit polohu dvojné nebo trojné vazby. Číslování musí začínat od nejbližšího konce tohoto odkazu.
| 1,3-butadien | |
| 1-butyn |
Více se dozvíte na:
- Butan
- Metan
Druhy uhlovodíků
Podívejte se na hlavní typy uhlovodíků, jejich vlastnosti a použité sloučeniny:
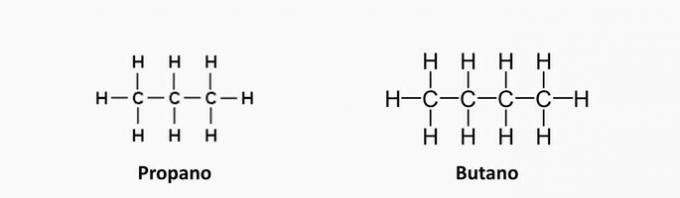
alkany
Jsou to uhlovodíky s otevřeným řetězcem s jednoduchými vazbami mezi atomy uhlíku a vodíku, jejichž obecný vzorec je CNeH2n + 2.
Alkanové charakteristiky
- Nazývají se také parafiny nebo parafiny.
- Vyskytují se v přírodě v zemním plynu a ropě.
- Používají se jako paliva: plyn na vaření, benzín, nafta atd.
Příklady alkanů

alkeny
Jsou to uhlovodíky s otevřeným řetězcem a mají dvojnou vazbu, jejichž obecný vzorec je CNeH2n.
Alkenovy charakteristiky
- Nazývají se také olefiny, alkeny nebo ethylenické uhlovodíky.
- Průmyslově se získávají krakováním alkanů přítomných v oleji.
- Používají se jako surovina v průmyslu: plasty, barviva, výbušniny atd.
Příklady alkenů

Alkyny
Jsou to uhlovodíky s otevřeným řetězcem s přítomností dvojné vazby, jejichž obecný vzorec je CNeH2n-2.
Alkynové charakteristiky
- Díky trojné vazbě jsou reaktivnější než alkany a alkeny.
- Alkyny s více než 14 atomy uhlíku jsou pevné látky.
- Nejpoužívanějším alkynem je acetylen, běžně používaný při výrobě syntetických kaučuků, textilních vláken a plastů.
Příklady alkynů

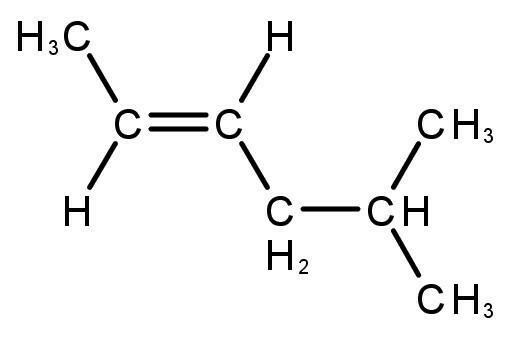
Alkadienes
Jsou to uhlovodíky s otevřeným řetězcem a přítomnost dvou dvojných vazeb, jejichž obecný vzorec je CNeH2n-2
Charakteristika alkadienů
- Také se jim říká dienes nebo diolefiny
- V přírodě se nacházejí v terpenech extrahovaných z éterických ovocných olejů.
- Nejznámější sloučeninou je isopren, který se nachází v přírodním kaučuku a éterických olejích.
Příklady alkadienů

Cyclans
Jsou to uhlovodíky s uzavřeným řetězcem s jednoduchými vazbami mezi atomy uhlíku a vodíku, jejichž obecný vzorec je CNeH2n.
Cyclan Charakteristiky
- Nazývají se také cykloalkany nebo cykloparafiny.
- Jsou nestabilní při působení vysokého tlaku.
- Řetězy s více než 6 uhlíky jsou stabilní, zatímco řetězy s méně než 5 uhlíky jsou reaktivní.
Příklady cyklanů

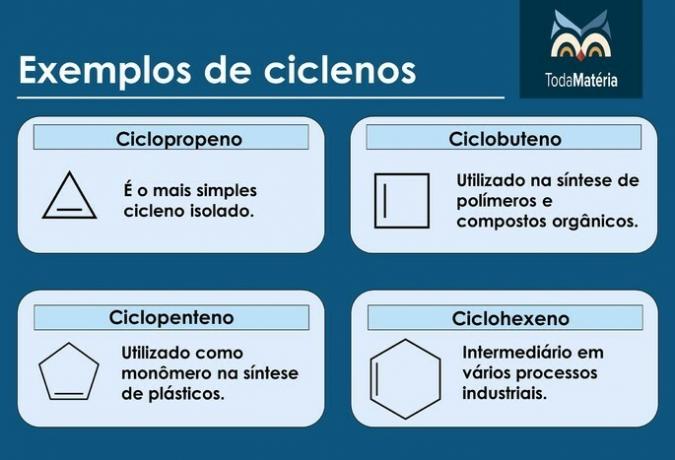
Cykly
Jsou to uhlovodíky s uzavřeným řetězcem s přítomností dvojné vazby, jejíž strukturní vzorec je CNeH2n-2.
Charakteristika cyklenů
- Také se jim říká cykloalkeny.
- Sloučeniny s 3 až 5 uhlíky jsou nestabilní.
- Obvykle se nacházejí v zemním plynu, ropě a ropě.
Příklady cyklenů
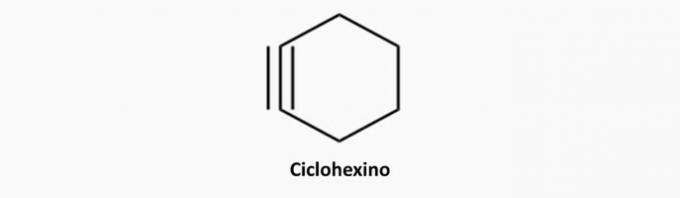
cyklisté
Jsou to uhlovodíky s uzavřeným řetězcem s přítomností trojné vazby, jejíž strukturní vzorec je CNeH2n-4.
Cyklistické vlastnosti
- Nazývají se také cykloalkyny nebo cykloalkyny.
- Jsou to cyklické a nenasycené uhlovodíky.
- Jsou nestabilní kvůli trojné vazbě a nenacházejí se v přírodě.
Příklady cyklinů

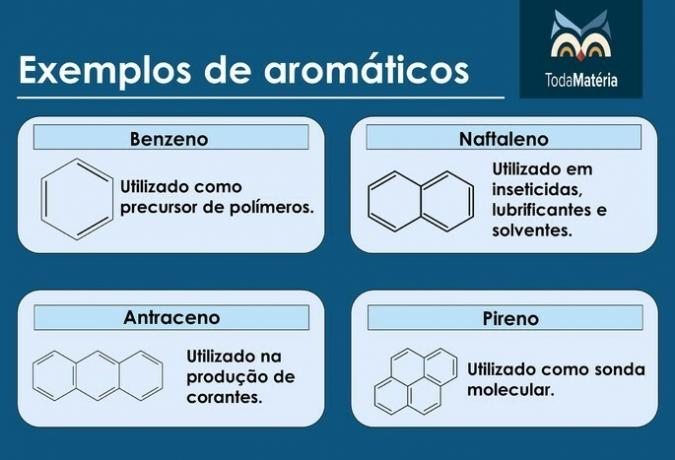
Aromatika
Jsou to uzavřené řetězce uhlovodíků se střídavými jednoduchými a dvojnými vazbami.
Charakteristika aromatických látek
- Nazývají se také arény.
- Jsou to nenasycené sloučeniny, protože mají 3 dvojné vazby.
- Skládají se z alespoň jednoho aromatického kruhu.
Příklady aromatických látek
- Ropa
- čištění ropy
- Acetylén
Shrnutí uhlovodíků
| obsazení | Obecný vzorec |
Funkce |
|---|---|---|
| alkan | Otevřený řetěz s jednoduchými články. |
|
| alken | Otevřený řetěz s dvojnou vazbou. | |
| alkyn | Otevřený řetěz s trojitou vazbou. | |
| alkadien | Otevřený řetězec se dvěma dvojnými vazbami. | |
| Cyclans | Uzavřený řetěz s jednoduchými spoji. | |
| Cykly | Uzavřený řetěz s dvojnou vazbou. | |
| cyklisté | Uzavřený řetěz s trojitým článkem. | |
| Aromatický | Variabilní | Uzavřený řetězec se střídáním jednoduchých a dvojných vazeb. |
Cvičení na uhlovodíky
1. (UEMA) LPG (zkapalněný ropný plyn), také známý jako plyn na vaření, je palivo neobnovitelné fosilie, které mohou docházet přes noc, pokud nebudou použity s plánováním a bez nich přebytek. Je složen mimo jiné z propanu C3H8, butan C.4H10 a malé množství propylenu C3H6 a buten C.4H8. Tyto organické sloučeniny jsou klasifikovány jako uhlovodíky, které mají mezi sebou podobnosti a rozdíly. Na základě typu vazby mezi uhlíky a klasifikace uhlíkového řetězce výše uvedených sloučenin lze konstatovat, že:
a) nenasycené sloučeniny jsou propan a butan.
b) nenasycenými sloučeninami jsou propen a buten.
c) nenasycené sloučeniny jsou propen a butan.
d) sloučeniny mají homocyklické řetězce.
e) sloučeniny mají heterocyklické řetězce.
Alternativně b) nenasycenými sloučeninami jsou propen a buten.
a) NESPRÁVNÉ. Tyto sloučeniny nemají nenasycení, jejich vazby jsou jednoduché.
b) SPRÁVNĚ. Termín „en“ označuje přítomnost dvojných vazeb ve sloučeninách.

c) NESPRÁVNÉ. Butan nemá žádné nenasycení.

d) NESPRÁVNÉ. Tyto řetězce jsou uzavřené a atomy uhlíku jsou spojeny jednoduchými vazbami.
e) NESPRÁVNÉ. Tyto řetězce mají heteroatom, jako je kyslík a dusík.

2. (Uel) Jeden z uhlovodíků vzorce C.5H12 může mít uhlíkový řetězec:
a) nasycený cyklický.
b) heterogenní acyklický.
c) rozvětvený cyklický.
d) nenasycené otevřené.
e) otevřené rozvětvené.
Alternativa e) otevřená rozvětvená.
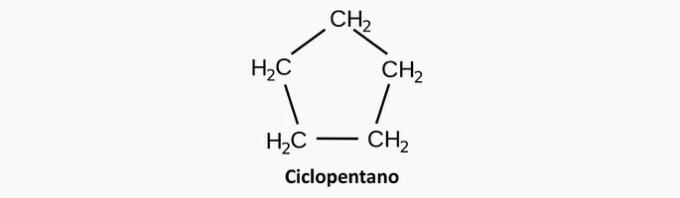
a) NESPRÁVNÉ. Nasycená cyklická sloučenina odpovídá cyklánu, jehož vzorec je CNeH2n.
Příklad:
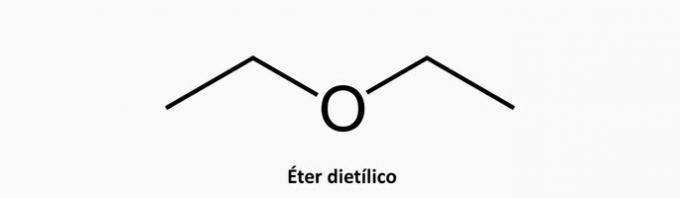
b) NESPRÁVNÉ. Heterogenní acyklická sloučenina má kromě interkalačního uhlíku v řetězci přítomnost dalšího prvku.
Příklad:
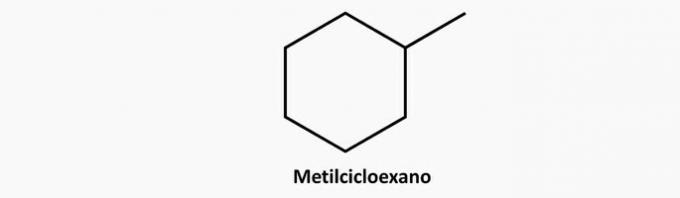
c) NESPRÁVNÉ. Rozvětvená cyklická sloučenina má vzorec C.NeH2n.
Příklad:
d) NESPRÁVNÉ. Nenasycenou sloučeninou s otevřeným řetězcem může být alken nebo alkyn, jejichž vzorec je C.NeH2n a C.NeH2n-2.
Příklady:
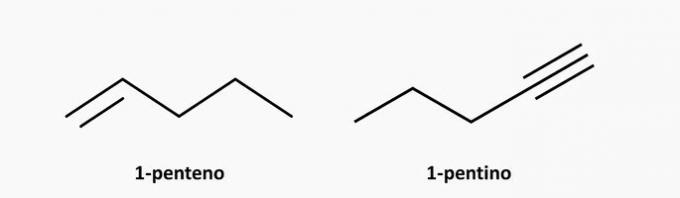
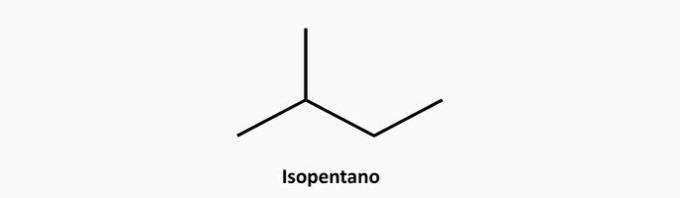
e) SPRÁVNĚ. Rozvětvenou sloučeninou s otevřeným řetězcem je alkan, jehož vzorec je CNeH2n + 2. Sloučeninou s 5 uhlíky a 12 vodíky by mohl být isopentan.
Příklad:
3. (PUC) Alkyny jsou uhlovodíky:
a) nasycené alifatické látky.
b) nasycené alicyklické látky.
c) nenasycené alifatické sloučeniny s dvojnou vazbou.
d) nenasycené alicyklické sloučeniny s trojnou vazbou.
e) trojné vazby nenasycených alifatik.
Alternativa e) nenasycené alifatické sloučeniny s trojnou vazbou.
a) NESPRÁVNÉ. Sloučeniny s otevřeným řetězcem a jednoduchými vazbami jsou alkany.
Příklad:

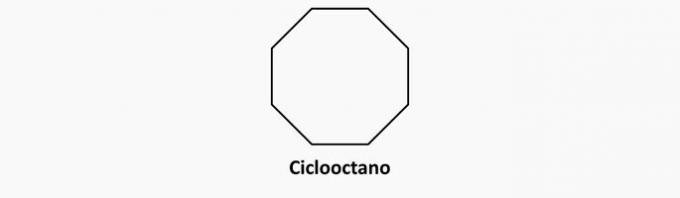
b) NESPRÁVNÉ. Cyklické sloučeniny s jednoduchými vazbami jsou cyklány.
Příklad:
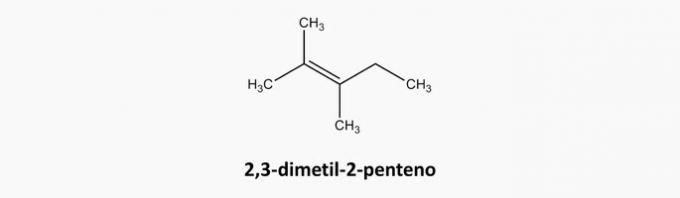
c) NESPRÁVNÉ. Sloučeniny s otevřeným řetězcem a dvojnými vazbami jsou alkeny.
Příklad:
d) NESPRÁVNÉ. Cyklické a trojně vázané sloučeniny jsou cykliny.
Příklad:
e) SPRÁVNĚ. Alkyny jsou sloučeniny s otevřeným řetězcem a trojné vazby.

Chcete si stále ověřovat své znalosti? Nezapomeňte se podívat na tyto seznamy:
- Cvičení na uhlovodíky
- Cvičení z organické chemie
- Cvičení na organické funkce