Studium síly a kyselina je velmi důležité pro stanovení schopnosti kyselého roztoku vést elektrický proud, protože to souvisí s množstvím iontů, které tato látka produkuje při kontaktu s vodou (ionizace). Když je kyselina příliš silná, produkuje příliš mnoho hydroniových kationtů (H3Ó+) a mnoho aniontů (X-). Podívejte se na rovnici ionizace kyseliny bromovodíkové:
HBr + H2O → H3Ó+ + Br-
Při ionizaci vodík přítomný v molekule kyseliny interaguje s molekulou vody a tvoří hydronium. Aby však k této události mohlo dojít, musí být atom vodíku nutně ionizovatelný. Ionizovatelný vodík je atom schopný vytvořit hydroniový kation.. Abychom zjistili, zda je vodík ionizovatelný, vezmeme v úvahu klasifikaci kyseliny jako hydracidní (ve svém složení nemá kyslík) nebo oxykyselinu (ve svém složení má kyslík).
a) Hidracidy
Veškerý vodík v hydracidě je považován za ionizovatelný.
Příklady:
- HCl: ionizovatelný vodík, čímž vzniká hydronium;
Nepřestávejte... Po reklamě je toho víc;)
- H2S: Dva ionizovatelné vodíky, pak produkují dva hydrony
b) Okyselina
V kyselině, za ionizovatelný je považován pouze vodík, který je navázán na atom kyslíku v molekule. K tomu je nutné sestavit jeho strukturní vzorec. Podívejte se na několik příkladů:
H3PRACH4 (kyselina fosforečná)
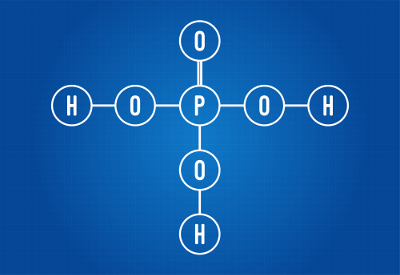
Strukturní vzorec kyseliny fosforečné
Vidíme, že ve struktuře kyseliny fosforečné jsou na kyslík vázány tři vodíky, takže existují tři ionizovatelné vodíky. Ionizační rovnice bude:
H3PRACH4 + 3 H2O → 3 H3Ó+ + PO4-3
H2POUZE4 (kyselina sírová)
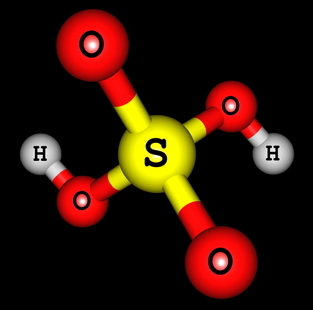
Strukturní vzorec kyseliny sírové
Vidíme, že ve struktuře kyseliny sírové existují dva vodíky vázané na kyslík, takže existují dva ionizovatelné vodíky. Ionizační rovnice bude:
H2POUZE4 + 2 H2O → 2 H3Ó+ + OS4-2
Podle mě. Diogo Lopes Dias
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
DNY, Diogo Lopes. „Ionizovatelné vodíky“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/hidrogenios-ionizaveis.htm. Zpřístupněno 28. června 2021.
Chemie

Disociace a ionizace, italský vědec Volta, elektrický proud, švédský fyzikální chemik Svant August Arrhenius, teorie Arrhenius, kladné ionty, kationty, záporné ionty, anionty, hydroxid sodný, stolní sůl, polární molekuly, disociace iontový,