Valenční vrstva je poslední vrstvou elektronové distribuce atomu. Jelikož je to nejvzdálenější vrstva, je také nejdále od atomového jádra.
Podle Pravidlo oktetuvalenční obal potřebuje ke stabilizaci osm elektronů.
Atomy tedy získávají stabilitu, když mají ve valenčním plášti 8 elektronů. K tomu dochází u vzácných plynů, které mají úplnou valenční vrstvu. Jedinou výjimkou je prvek Helium, který má 2 elektrony.
Ostatní prvky potřebují vytvořit chemické vazby, aby přijaly chybějící elektrony a dosáhly osmi elektronů ve valenčním plášti.
Valenční skořápkové elektrony jsou ty, které se účastní vazeb, protože jsou nejvíce vnější.
Elektrosférické vrstvy
Podle atomového modelu Rutherford-Bohra se elektrony točí kolem atomového jádra v různých energetických vrstvách.
Existuje sedm vrstev označených písmeny K, L, M, N, O, P a Q. Každý z nich podporuje maximální počet elektronů.
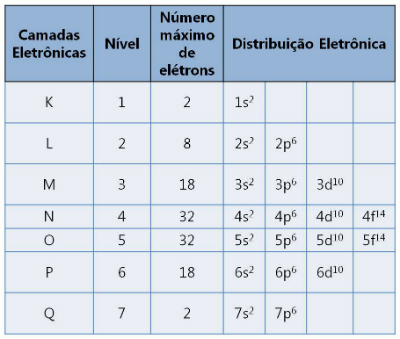 Elektronické vrstvy a počty elektronů, které podporují
Elektronické vrstvy a počty elektronů, které podporují
Přečtěte si také:
- Bohrův atomový model
- Rutherfordův atomový model
- Vzácné plyny
- Pravidlo oktetu
Jak určit vrstvu Valencie?
Valenční vrstvu lze určit dvěma způsoby: Elektronická distribuce a Periodická tabulka.
Chcete-li určit valenční vrstvu pomocí elektronické distribuce, Linus Pauling diagram.
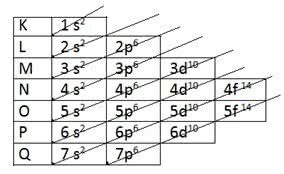 Paulingův diagram
Paulingův diagram
Připomeňme, že Paulingův diagram sleduje rostoucí pořadí energie. Poslední vrstvou získanou v elektronické distribuci je valenční vrstva.
1 s2 2 s2 2 s6 3 s2 3p6 4 s2 3d10 4p6 5 s2 4d10 5p6 6 s2 4f14 5 d10 6p6 7 s2 5f14 6d10 7p6
Ve valenční vrstvě je tedy nejenergetičtější podúrovní poslední vrstva.
Příklady:
Dusík - N
Atomové číslo: 7
Elektronická distribuce: 1 s2 2 s2 2 s3
Valencia vrstva: 2 s2 2 s3, N má ve valenčním plášti 5 elektronů.
Železo - Fe
Atomové číslo: 26
Elektronická distribuce: 1 s2 2 s2 2 s6 3 s2 3p6 4 s2 3d6
Valencia vrstva: 4 s2„Fe má ve valenčním plášti 2 elektrony.
Chlor - Cl
Atomové číslo: 17
Elektronická distribuce: 1 s2 2 s2 2 s6 3 s2 3p5
Valencia vrstva: 3 s2 3p5, Cl má ve valenčním plášti 7 elektronů.
Kyslík - O.
Atomové číslo: 8
Elektronická distribuce: 1 s2 2 s2 2 s4
Valencia vrstva: 2 s2 2 s4, kyslík má ve valenčním plášti 6 elektronů.
Uhlík - C.
Atomové číslo: 6
Elektronická distribuce: 1 s2 2 s2 2 s2
Valencia vrstva: 2 s2 2 s2„uhlík má ve valenčním plášti 4 elektrony.
Přečtěte si také o Kvantová čísla.
Dosud se používaly příklady s prvky v základním stavu. Lze však použít stejný princip ionty, kationty a anionty. Viz příklad:
Chloridový anion - Cl-
Atomové číslo chloru je 17. Pokud by byl v základním stavu, počet elektronů by se rovnal počtu protonů. V tomto případě však existuje zisk 1 elektronu.
Nejprve proveďte elektronickou distribuci prvku chloru:
1 s2 2 s2 2 s6 3 s2 3p5
Se ziskem dalšího elektronu přidejte do poslední vrstvy:
1 s2 2 s2 2 s6 3 s2 3p6. Ve valenčním plášti je tedy 8 elektronů (3 s2 3p6).
Podívejte se také: Cvičení z elektronické distribuce.
Chcete-li určit valenční vrstvu prostřednictvím periodické tabulky, je nutné identifikovat období a rodinu prvků.
Zatímco tedy 1A rodina má 1 valenční elektron, 2A má 2 atd. Chemické prvky v něm obsažené rodina periodických tabulek mít stejný počet elektronů ve valenčním plášti.
To však platí pouze pro skupiny 1, 2, 13, 14, 15, 16 a 17, které mají následující počet elektronů ve valenčním plášti 1, 2, 3, 4, 5, 6 a 7.
U prvků, kde tento vztah není možný, by se měla použít elektronická distribuce.
Nezapomeň! Na chemické vazby vznikají z potřeby stabilizovat atomy a vytvářet tak molekuly. Děje se tak darováním elektronů z valenčního pláště, které, protože jsou dále od jádra, mají tendenci darovat.
Přečtěte si také o Molekulární geometrie.
Cvičení
1. Najděte valenční vrstvu následujících prvků:
Bróm
35br
1 s2 2 s2 2 s6 3 s2 3p6 4 s2 3d10 4p5
Brominová valenční skořápka (rodina 7A) má 7 elektronů. To proto, že 4s2 a 4p5 patří do N vrstvy, zatímco 3d10 patří do vrstvy M.
Hliník
13Al
1 s2 2 s2 2 s6 3 s2 3p1
Hliníkový valenční obal (rodina 3A) má 3 elektrony.
2. (UFSC) Počet elektronů v každé podúrovni atomu stroncia (38Sr) ve vzestupném pořadí energie je:
a) 1 s2 2 s2 2 s6 3 s2 3p6 4 s2 3d10 4p6 5 s2
b) 1 s2 2 s2 2 s6 3 s2 3p6 4 s2 4p6 3d10 5 s2
c) 1 s2 2 s2 2 s6 3 s2 3p6 3d10 4 s2 4p6 5 s2
d) 1 s2 2 s2 2 s6 3 s2 3p6 4p6 4 s2 3d10 5 s2
e) 1 s2 2 s2 2 s6 3p6 3 s2 4 s2 4p6 3d10 5 s2
a) 1 s2 2 s2 2 s6 3 s2 3p6 4 s2 3d10 4p6 5 s2
3. (IFSP / 2013) Počet elektronů ve valenčním obalu atomu vápníku (Z = 20) v základním stavu je
až 1
b) 2
c) 6
d) 8
e) 10
b) 2
Zkontrolujte otázky přijímací zkoušky s komentovaným rozlišením v: Cvičení na periodické tabulce.