Experimenty jsou praktickým způsobem, jak se naučit a otestovat své znalosti konceptů studovaných v chemii.
Využijte tyto chemické experimenty, které lze provádět doma (pod dohledem dospělé osoby) nebo na nichž můžete pracovat ve třídě s učitelem, a doplnit tak vaše studium.
1. zkušenost - rozluštění barev
Jedná se o koncepty: chromatografie a separace směsí
Materiály
- pera (značkovače) různých barev
- alkohol
- kávový filtrační papír
- šálek (sklo usnadňující sledování experimentu)
Jak udělat
- Použijte nůžky a nastříhané proužky filtračního papíru. Pro každé použité pero vytvořte obdélník.
- Nyní ve vzdálenosti přibližně 2 cm od základny nakreslete vybraným barevným perem kruh a namalujte celý vnitřek.
- Přilepte okraj papíru nejdále od nakresleného mramoru na podložku. K tomu můžete použít pásku a připevnit ji na tužku.
- Přidejte do sklenice alkohol, ne příliš, protože by se měl jen dotýkat konce papíru poblíž značky pera.
- Vložte papír do šálku tak, aby byl svislý. Tužka, která ji podporuje, by měla spočívat na okrajích.
- Počkejte mezi 10 a 15 minutami, než alkohol vyteče přes filtrační papír. Poté papíry vyjměte a nechte je zaschnout.
Výsledek
Když alkohol projde značkou pera, interaguje s barevnými složkami a pohání je přes papír. Různé pigmenty budou tedy odděleny kontaktem s alkoholem.
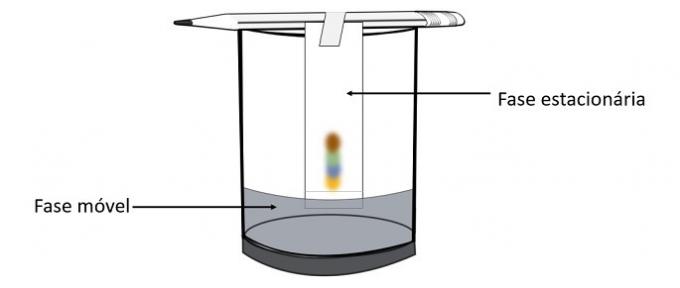
Prostřednictvím tohoto experimentu je možné zjistit, které barvy byly smíchány, aby se vytvořila barva pera.
Vysvětlení
Chromatografie je typ procesu separace směsí. Filtrační papír je stacionární fáze a alkohol je mobilní fáze, která táhne složky směsi, když prochází stacionární fází. V tomto procesu, čím větší je interakce s alkoholem, tím rychleji se bude pigment pohybovat s průchodem rozpouštědla.
Složky materiálu, protože mají různé vlastnosti, budou interagovat s mobilní fází různými způsoby, což si můžete všimnout podle různých dob tažení ve stacionární fázi.
Dozvědět se víc o chromatografie.
2. zkušenost - konzervace potravin
Jedná se o pojmy: organické sloučeniny a chemické reakce
Materiály
- jablko, banán nebo hruška
- citronový nebo pomerančový džus
- Vitamin C tablety
Jak udělat
- Vyberte si jedno ze tří druhů ovoce a nakrájejte ho na 3 stejné části.
- První díl bude sloužit jako srovnání s ostatními. Takže k tomu nic nepřidávejte, nechte to vystavené vzduchu.
- Do jednoho z kousků odkapejte obsah citronu nebo pomeranče. Rozetřete tak, aby byla celá vnitřek ovoce pokryta šťávou.
- V poslední části rozetřete vitamin C, může to být drcená tableta po celé ovocné dužině.
- Sledujte, co se stane, a porovnejte výsledky.
Výsledek
Dužina ovoce, která byla vystavena vzduchu, by měla rychle ztmavnout. Citronový nebo pomerančový džus a vitamin C, chemická látka zvaná kyselina askorbová, by měly zpomalit zhnědnutí ovoce.

Vysvětlení
Když nakrájíme ovoce, jeho buňky jsou poškozeny a uvolňují enzymy, jako je polyfenol oxidáza, která dovnitř kontakt se vzduchem oxiduje fenolové sloučeniny přítomné v potravinách a způsobuje enzymatické hnědnutí.
Aby se zabránilo působení kyslíku, používají se konzervační látky, jako je kyselina askorbová, protože jsou přednostně oxidovány místo fenolových sloučenin. Kromě tablety s vitaminem C je kyselina askorbová přítomna také v přírodních zdrojích, jako jsou citrusy, citron a pomeranč, navržených v experimentu.
Dozvědět se víc o oxidace.
3. zkušenost - kdo zamrzne rychleji?
Zapojené koncepty: coligative vlastnosti a kryoskopie
Materiály
- dvě trubice (používané pro party laskavosti)
- skleněná mísa
- stolní sůl
- filtrovaná voda
- led
- teploměr
Jak udělat
- Do obou zkumavek přidejte stejné množství filtrované vody. Například 5 ml v každé zkumavce.
- Přidejte kuchyňskou sůl do jedné zkumavek a umístěte identifikační pásku, abyste rozlišili, která je slaná.
- Naplňte skleněnou nádobu drceným ledem a přidejte trochu soli.
- Umístěte dvě zkumavky současně do ledu a sledujte, co se stane.
- Zaznamenejte teplotu mrazu pro každou situaci.
Výsledek
Přidáním rozpuštěné látky do vody se sníží teplota mrazu. Čistá voda má tedy tendenci zmrznout mnohem rychleji než roztok soli a vody, pokud je vystavena stejným podmínkám.
Vysvětlení
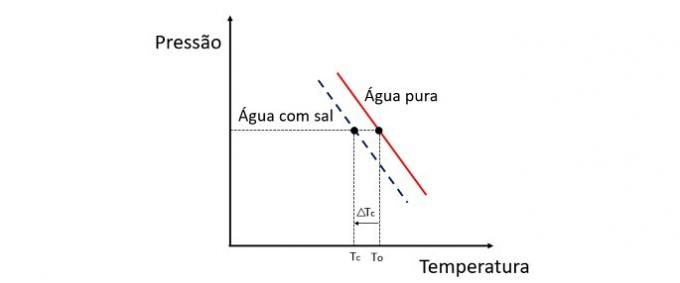
Kryoskopie je koligativní vlastnost, která studuje kolísání teploty rozpouštědla, když je v něm rozpuštěno různé množství rozpuštěné látky.
Snížení teploty tuhnutí vody je způsobeno netěkavou látkou a tento jev má mnoho praktických aplikací. Proto vyšší koncentrace rozpuštěné látky v roztoku ovlivňuje kryoskopický účinek.
Pokud například voda zamrzne při 0 ° C a přidáme k ní sůl, bude teplota fázové změny záporná, tj. Mnohem nižší.
Proto mořská voda nezamrzá na místech, kde je teplota nižší než 0 ° C. Sůl rozpuštěná ve vodě má tendenci dále snižovat teplotu tuhnutí. Na místech, kde je sníh, je také běžné sypat na silnice sůl, aby se roztavil led a zabránilo se nehodám.
Dozvědět se víc o Koligativní vlastnosti.
4. experiment - rozklad peroxidu vodíku
zapojené koncepty: chemická reakce a katalyzátor
Materiály
- Napůl syrové brambory a napůl vařené
- Kousek syrových jater a další vařený kousek
- Peroxid vodíku
- 2 jídla
Jak udělat
- Do každého pokrmu přidejte jídlo, brambory a játra.
- Do každého ze čtyř materiálů přidejte 3 kapky peroxidu vodíku.
- Sledujte, co se stane, a porovnejte výsledky.
Výsledek
Peroxid vodíku, roztok peroxidu vodíku, při kontaktu se syrovými potravinami začíná téměř okamžitě šumět.
Tento experiment lze také provést přidáním kousku jídla do nádoby s peroxidem vodíku, aby byla reakce znatelnější.
Vysvětlení
Šum, který peroxid vodíku představuje při kontaktu se syrovými potravinami, charakterizuje výskyt chemické reakce, což je rozklad peroxidu vodíku a uvolnění plynu kyslík.
K rozkladu peroxidu vodíku dochází působením enzymu katalázy, který se nachází v organisech peroxisomes a je přítomen v živočišných a rostlinných buňkách.
Je důležité zdůraznit, že k rozkladu peroxidu vodíku dochází spontánně, za přítomnosti slunečního světla, ale ve velmi pomalé reakci. Kataláza však působí jako katalyzátor a zvyšuje rychlost chemické reakce.
Peroxid vodíku může být toxická látka pro buňky. Kataláza proto štěpí sloučeninu a produkuje vodu a kyslík, dvě látky, které nepoškozují tělo.
Když se jídlo vaří, jeho součásti procházejí změnami. Úpravy způsobené vařením také narušují působení katalázy denaturací bílkovin.
Stejná akce, jakou vidíme u jídla, se stane, když si na ránu dáme peroxid vodíku. Kataláza působí a dochází k tvorbě bublin, které spočívají v uvolňování kyslíku.
Dozvědět se víc o chemické reakce.
Bibliografické odkazy
SAINTS, W. L. P.; MOL, G. S. (Coords.) Občanská chemie. 1. vyd. São Paulo: Nová generace, 2011. proti. 1, 2, 3.
BRAZILSKÁ CHEMICKÁ SPOLEČNOST (org.) 2010. Chemie ve vašem okolí: levné experimenty pro učebnu K-12. 1. vyd. Sao Paulo.


