Podle modelu orbitalů vytvořeného Linusem Paulingem v roce 1960 byla kovalentní vazba, která tvoří molekuly nastávají fúzí nebo interpenetrací neúplných orbitalů prvků zapojených do Odkaz. Proto se dospělo k závěru, že pokud má prvek neúplný orbitál (pouze s jedním elektronem), může vytvořit pouze kovalentní vazbu. Pokud má dvě neúplné orbitaly, může provést maximálně dvě spojení atd.
Podívejte se však na atomové orbitaly atomu uhlíku prvku, který má atomové číslo rovné 6 (Z = 6):
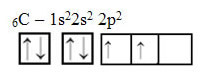
Všimněte si, že má dva neúplné orbitaly, takže by měl provádět maximálně pouze dvě vazby. To se mu však nestalo. Jak mnozí vědí, uhlík vytváří čtyři vazby (je čtyřmocný), takže tento model orbitalů nevysvětluje případ uhlíku.
K ukončení této slepé uličky byla vytvořena nová teorie, která lépe vysvětlila tento problém: Hybridizační teorie.

To znamená, že hybridizace je „směsicí“ čistých orbitalů.
U uhlíku existují tři typy hybridizace, které jsou: sp3, sp2 a sp.
Abychom pochopili, jak dochází k hybridizaci, podívejme se na první typ hybridizace uhlíku, typ sp.3:
K tomuto typu hybridizace dochází v molekule metanu (CH4). Všimněte si, že existují čtyři identické kovalentní vazby mezi uhlíkem, který je ústředním prvkem, a čtyřmi vodíky. Podívejte se, co je to nekompletní vodíkový orbitál:
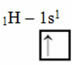
Protože každý vodík má neúplný orbitál typu s, je nutné přijmout ještě jeden elektron, to znamená, že každý vytvoří pouze jednu kovalentní vazbu s uhlíkem. Proto uhlík musí mít čtyři neúplné orbitaly. Jak se to stalo? Hybridizací.
Když elektron z orbitálu 2s absorbuje energii, prochází do prázdné orbitálu 2p. Říkáme tedy, že tento skok elektronu z 2s do 2p podúrovně je „podporou“ elektronu. Tímto způsobem uhlík zůstává ve svém vzrušeném nebo aktivovaném stavu, přičemž k provedení kovalentních vazeb jsou k dispozici čtyři hybridizované orbitaly:
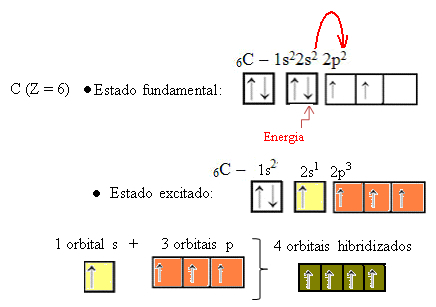
Všimněte si, že vytvořené hybridní orbitaly jsou navzájem rovnocenné, ale liší se od původních čistých orbitalů.
Tímto způsobem dochází k vazbě mezi orbitálem každého ze čtyř atomů vodíku u těchto čtyř hybridizovaných uhlíkových orbitalů:
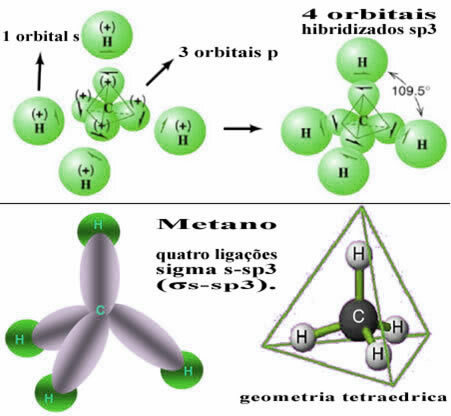
Jak je vidět výše, molekula metanu má pravidelnou čtyřstěnnou strukturu se čtyřmi elektronovými mraky v každém vrcholu a sousedními úhly 109 ° 28 '. Protože vazba byla vytvořena mezi orbitálem každého vodíku a hybridizovaným sp orbitálem3 pro každé spojení máme, že jsou čtyři sigma s-sp odkazy3 (σs-sp3).
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm
