Povrchové napětí je jev, který se vyskytuje na povrchu kapalin, jako je voda, a vytváří tenký film.
Když voda v kapalném stavu obsadí nádobu, můžeme vnímat oddělení mezi kapalinou a prostředím. Je to proto, že interakce mezi molekulami vody na povrchu se liší od interakcí uvnitř kapaliny.
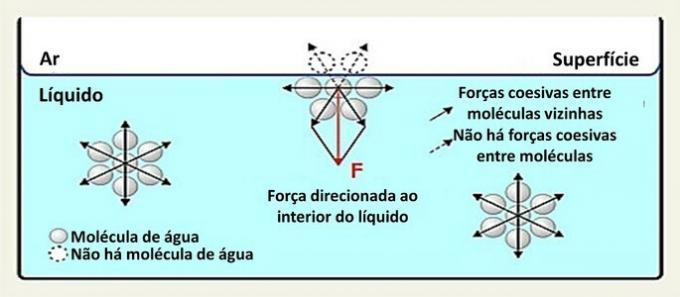
Na povrchu molekula vody interaguje s molekulami po stranách a pod ní. Uvnitř je molekula obklopena jinými molekulami a dochází k interakci ve všech směrech prostřednictvím vodíkových vazeb.
Právě díky této vlastnosti pozorujeme fenomén vzniku kapičky. Z tohoto důvodu je také možné, aby hmyz chodil po vodě.
Co je to povrchové napětí?
Jedná se o vytvoření tenkého filmu pod kapalinou v důsledku nerovnosti přitažlivosti mezi molekulami, které jej tvoří. Tento jev se vyskytuje výrazněji u kapalin, které mají mezimolekulární síly intenzivní, jako voda.
Interakce mezi druhy v kapalině se nazývají soudržné síly. Zatímco molekuly uvnitř kapaliny jsou přitahovány k sousedním molekulám ve všech směrech, molekuly na povrchu interagují s molekulami pod nimi a vedle nich.
Podívejte se, jak dochází k povrchovému napětí ve vodě.
Voda (H2O) je polární molekula tvořená 2 atomy vodíku (kladné póly) a jedním atomem kyslíku (záporný pól) spojeným kovalentní vazby. Kladný pól molekuly je přitahován k zápornému pólu sousední molekuly a vytváří vodíkové vazby.
Tento typ interakce v kapalině je distribuován ve všech směrech. Na povrchu jsou síly směrovány dolů a do stran, protože nad nimi nejsou žádné molekuly vody. Díky tomu jsou povrchové molekuly soudržnější a vytvoří se elastický film.
Jednotka povrchového napětí je dána kvocientem mezi jednotkou síly a jednotkou délky, přičemž nejpoužívanější je dyn / centimetr (dyn / cm) a newton / metr (N / m).
Voda má vysoké povrchové napětí, jehož hodnota je 72,75 dyne / cm. Rtuť, tekutý kov, má však povrchové napětí přibližně 7krát větší než voda, 475 dyn / cm.
Chcete vědět více? Podívejte se tedy na následující texty:
- Vlastnosti vody
- Polární a nepolární molekuly
- Chemické vazby
Jevy způsobené povrchovým napětím
Povrchové napětí je zodpovědné za některé jevy, které pozorujeme v každodenním životě. Mezi hlavní patří:
Zvířata, která chodí po vodě

Hmyz, pavouci a jiná zvířata mohou chodit nebo odpočívat na Voda protože na končetinách jeho tlapek jsou chlupy potažené mastnou látkou, a proto nemohou pronikat mezi molekuly vody spojené na povrchu.
Tvorba vodních kapiček

Kapky vody jsou sférické kvůli kontrakci v molekuly povrchu způsobeného povrchovým napětím. Koule se vyskytuje, protože se jedná o geometrický tvar, ve kterém existuje nejmenší vztah mezi povrchovou plochou a objemem. Proto sférický tvar udržuje nejmenší počet molekul vody ve styku se vzduchem.
Cvičení na povrchové napětí vody
1. Povrchově aktivní látka je látka, která na jiné působí na jinou látku:
a) osmolarita.
b) Povrchové napětí.
c) Elektroforéza.
d) Viskozita.
e) Osmotický tlak.
Správná alternativa: b) Povrchové napětí.
a) NESPRÁVNÉ. Osmolarita souvisí s množstvím rozpuštěných částic, které jsou obsaženy v daném objemu rozpouštědla.
b) SPRÁVNĚ. Čisticí prostředky i mýdla snižují povrchové napětí vody a obecně se nazývají povrchově aktivní látky, protože molekuly těchto materiálů jsou umístěny mezi molekulami vody a snižují napětí povrchní.
c) NESPRÁVNÉ. Elektroforéza je technika separace molekul podle jejich nábojů.
d) NESPRÁVNÉ. Viskozita je fyzikální vlastnost, která určuje odpor kapaliny vůči proudění.
e) NESPRÁVNÉ. Osmotický tlak je koligativní vlastnost, která odpovídá tlaku, který musí být vyvíjen na systém, aby se zabránilo spontánnímu výskytu osmózy.
Další informace o problémech zahrnutých v tomto čísle:
- Vlastnosti hmoty
- Koligativní vlastnosti
- Osmotický tlak
2. Povrchové napětí kapalin závisí přímo na interakčních procesech mezi molekulami, jako je například vodíková vazba. Která z níže uvedených látek má nejvyšší povrchové napětí?
a) benzen
b) oktan
c) ethylalkohol
d) tetrachlormethan
e) kyselina ethanová
Správná alternativa: e) kyselina ethanová.
a) NESPRÁVNÉ. Benzen je uhlovodík, nepolární molekula a nedělá vodíkové vazby.
b) NESPRÁVNÉ. Oktan je uhlovodík, a proto se jedná o nepolární molekulu, která netvoří vodíkové vazby.
c) NESPRÁVNÉ. Ethylalkohol je mírně polární sloučenina, která může vytvářet vodíkové vazby, ale interakce mezi molekulami je omezená.
d) NESPRÁVNÉ. Chlorid uhličitý je nepolární organická sloučenina, a proto netvoří vodíkové vazby.
e) SPRÁVNĚ. Funkční skupina karboxylové kyseliny (-COOH) může vytvářet vodíkové vazby buď s kyslíkem, nebo s hydroxylovým vodíkem.

Další informace o problémech zahrnutých v tomto čísle:
- Polarita molekul
- Organické funkce
- Uhlovodíky
experiment povrchového napětí
Podívejte se na video níže s experimentem, který demonstruje povrchové napětí vody.



