Oxidace je chemická reakce, při které atomy, ionty nebo molekuly ztrácejí elektrony. Způsobuje také zvýšení počtu oxidace (nox).
Termín oxidace byl původně vytvořen k označení reakcí, ve kterých byl reaktantem kyslík. Bylo však zjištěno, že v některých případech k nim došlo při absenci tohoto prvku. Protože tento termín byl již všeobecně známý, pokračoval v používání.
Oxidační reakce probíhají současně s redukčními reakcemi. Proto se jim říká redox, ve kterém se přenášejí elektrony.
Při redoxních reakcích je oxidační činidlo tím, které přijímá elektrony a prochází redukcí. Redukční činidlo ztrácí elektrony a podléhá oxidaci.
Příklady oxidace
Oxidace železa
Rez je oxidace železa. Všechny kovy mohou podstoupit oxidaci. Vyskytuje se v důsledku kontaktu kovů se vzduchem a vodou. Zpočátku koroze což je opotřebení kovu v důsledku oxidace. Poté tvoří rez.
Podívejte se na reakci redox pro tvorbu rzi:
- Fe (s) → Fe2+ + 2e-. V této fázi ztrácí železo dva elektrony a podléhá oxidaci
- Ó2 + 2 H2O + 4e- → 4OH-. O redukce2
- 2 Fe + O2 + 2 hodiny2O → 2 Fe (OH)2. Obecná rovnice - Fe (OH)2 je hydroxid železitý, zodpovědný za hnědou barvu rzi.
K ochraně železa a oceli před oxidací lze použít galvanizační techniku. Skládá se z kovového zinkového povlaku. Je to však nákladný proces, který je v některých případech neproveditelný.
Trupy lodí a kovové plošiny tedy přijímají kovové hořčíkové bloky, které zabraňují oxidaci železa. Hořčík je považován za obětavý kov a je třeba ho občas vyměnit, až se opotřebuje.
Malování může také chránit kov před oxidací, ale není tak efektivní.

Rez
Přečtěte si také o Nerezová ocel a Slitiny kovů.
Oxidace v organické chemii
Kromě kovů může nastat také oxidace Uhlovodíky, zejména alkeny. Organická oxidace má čtyři formy: spalování, ozonolýzu, mírnou oxidaci a oxidaci energie.
Spalování
THE spalování je to chemická reakce látky s kyslíkem, která vrcholí produkcí světla a tepla. Kyslík se nazývá oxidační činidlo. Látka s uhlíkem je palivo.
Kyslík má funkci oxidačního paliva, je to oxidační činidlo spalování.
Spalování může být úplné nebo neúplné. Znát rozdíl mezi těmito dvěma způsoby:
- Kompletní spalování: Vyskytuje se, když je dostatečný přísun kyslíku. Na konci reakce oxid uhličitý (CO2) a voda (H2Ó).
- Nedokončené spalování: Není dostatek kyslíku, tvoří se kysličník uhelnatý (CO) a voda (H2Ó).
Ozonolýza
V tomto typu reakce je ozon činidlem, které způsobuje oxidaci alkenů. Dochází k rozbití dvojné vazby alkenů a tvorbě karbonylových sloučenin, jako je např aldehydy a ketony.
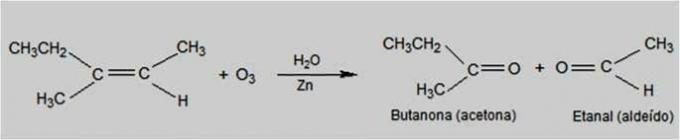
Reakce ozonolýzy
mírná oxidace
Mírná oxidace nastává, když je oxidačním činidlem sloučenina, jako je manganistan draselný (KMnO4), přítomný ve vodném roztoku, zředěný a chlazený, neutrální nebo slabě zásaditý.
K tomuto typu oxidace dochází pomocí Baeyerova testu, který se používá k rozlišení alkenů od izomerních cyklanů.
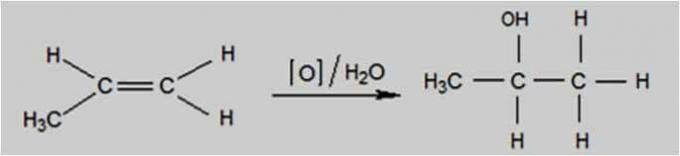
Mírná oxidační reakce
Oxidace energie
U tohoto typu oxidace se manganistan draselný nachází v teplejším a kyselějším prostředí, díky čemuž je reakce energičtější. Energetická oxidační činidla mohou narušit dvojnou vazbu alkenů.
V závislosti na struktuře alkenu mohou vznikat ketony a karboxylové kyseliny.
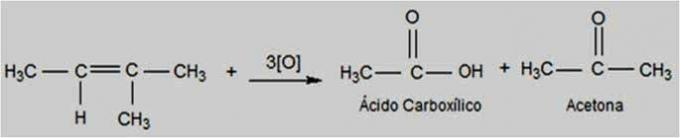
Energetická oxidační reakce
Chcete vědět více? Přečtěte si také o Elektrochemie.