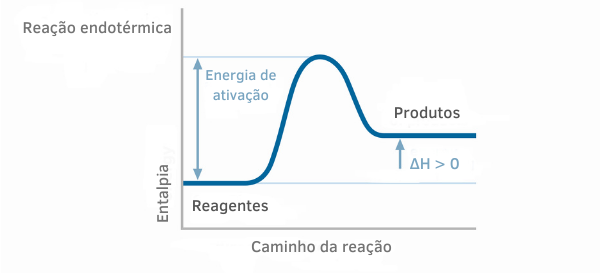
V textu „Název nebo procento hmoty„Viděli jsme, jak vypočítat poměr mezi hmotou rozpuštěné látky a hmotností roztoku pro pevné, kapalné a plynné roztoky. V tomto textu však uvidíme, že je také možné vypočítat titr z hlediska objemu u roztoků s kapalnými nebo plynnými složkami.

Titul v objemu lze vypočítat podle výrazu:
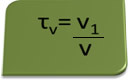
Vezměme si jako příklad vodný roztok ethylalkoholu použitého jako antiseptikum a dezinfekční prostředek, který byl připraveno přidáním 70 ml čistého alkoholu do dostatečného množství vody, aby se doplnil na objem 100 ml řešení. Takže máme:
τ = 70 ml = 0,7
100 ml
Můžeme také vyjádřit název v procentech, pouze vynásobíme výsledek 100%. Takže v tomto případě máme 70% roztok ethylalkoholu, což znamená, že ze každých 100 objemových jednotek roztoku je 70 objemových jednotek alkohol.
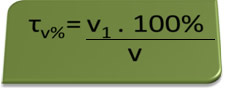
V níže uvedeném případě máme 70% roztok ethylalkoholu v objemu 250 ml roztoku; což podle výpočtů znamená 175 ml alkoholu:
100 ml 70 ml alkoholu
250 ml x
x = 70. 250
100
X = 175 ml alkoholu

Nemůžeme však říci, že v tomto případě máme 75 ml (250-175) vody. Na rozdíl od hmotnostního titru, ve kterém můžeme přidat hmotnost rozpouštědla k hmotnosti rozpuštěné látky, abychom zjistili hmotnost roztoku, to nelze provést ve vztahu k objemovému titru.

Nepřestávejte... Po reklamě je toho víc;)
To znamená, že objem roztoku se nerovná součtu objemu rozpouštědla a objemu rozpuštěné látky (i když často lze rozdíl považovat za zanedbatelný). Je to proto, že mezimolekulární síly, které existují v těchto kapalinách, ovlivňují konečný objem.
V případě výše uvedeného roztoku, například ethylalkoholu, když mícháme alkohol s vodou, dochází ke kontrakci celkového objemu roztoku; to znamená, že konečný objem bude menší, než kdybychom přidali samotný objem alkoholu a vody. Je to proto, že molekuly alkoholu vytvářejí vazby nebo vodíkové vazby s molekulami vody a zmenšují mezery mezi nimi.
Proto v tomto a dalších případech musí být objem roztoku měřen experimentálně, pokud není poskytnut při cvičení.
Objemové procento je široce používáno v případě alkoholických nápojů a komerčního alkoholu, jak je uvedeno výše. Podívejte se na dvě důležité aplikace tohoto výpočtu:
- Alkohol tester: dechový analyzátor měří koncentraci ethylalkoholu v krvi a v Brazílii je zakázáno kdokoli řídit jakýkoli typ vozidla s obsahem alkoholu v krvi rovným nebo vyšším než 0,1% objemových. Osoba s tímto obsahem alkoholu má na každý litr krve 1 ml alkoholu, jak vyplývá z následujících výpočtů:
τproti%=PROTI1. 100%
proti
0,1 % = PROTI1. 100%
1L
PROTI1 = 0,1% → V1 = 0,001 l = 1 ml
100%

- Obsah ethanolu v benzínu: v Brazílii je benzín regulován přidáváním ethanolu. Obsah ethanolu v benzínu však musí být nejvýše 24% objemových bezvodého alkoholu (protože benzín musí být bez vody). Čím více etanolu je do benzínu přidáno, tím více se barva paliva stává světlejší a jeho hustota se zvyšuje.
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. "Název svazku chemického roztoku"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm. Zpřístupněno 28. června 2021.
Chemie

Jak funguje alkohol tester, koncentrace alkoholu, alkohol tester, reakce zahrnující ethylalkohol, typy alkoholu dechové analyzátory, dichroman draselný, palivový článek, katalyzátor, uvolňování elektronů, kyselina octová, vodík, conce