Organické sloučeniny jsou molekulární, to znamená, že jejich atomy navzájem nesou kovalentní vazby. Když analyzujeme vazby mezi uhlíky, které mohou být jednoduché, dvojité nebo trojité, zjistíme, že jsou nepolární vazby, protože mezi atomy není žádný rozdíl v elektronegativitě, protože k nim patří živel.
Kromě toho, protože vodík a uhlík mají velmi malý rozdíl elektronegativity, jsou vazby mezi nimi také nepolární.
Nepolární připojení:
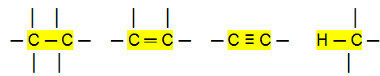
S tím můžeme dojít k závěru, že Uhlovodíky (organické sloučeniny, které mají pouze atomy uhlíku a vodíku) jsou nepolární molekuly. V těchto sloučeninách je intermolekulární interakce typu indukovaného dipólu, který je nejslabší, jaký existuje.
Jelikož jsou slabé, lze je snadno narušit. Z tohoto důvodu teploty varu a tání uhlovodíků jsou nižší než teploty jiných funkcí.

Při srovnání uhlovodíků body varu se zvyšují, jak se také zvyšuje molární hmotnost.
Například ethan a butan jsou oba alkany. Podívejte se na body varu každého experimentálně stanoveného:
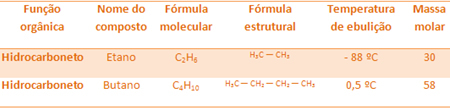
Všimněte si, že teplota varu butanu je mnohem vyšší než teplota varu etanu, protože jeho molární hmotnost je také vyšší.
Když nyní porovnáme uhlovodíky, které mají stejnou molární hmotnost (jsou to izomery), ale které mají různé typy uhlíkových řetězců, uvědomíme si, že čím větší je počet větví, tím nižší je teplota varu, protože struktura molekuly se stává kompaktnější, to znamená, že její povrch se zmenšuje.
Všechny níže uvedené alkany mají stejný molekulární vzorec C5H12, ale jejich teploty varu se liší:
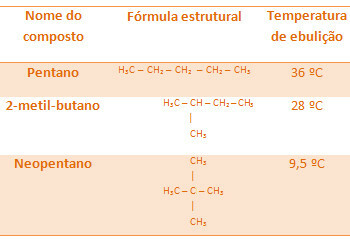
Všimněte si, že teplota varu neopentanu je nejnižší, protože má více větví.
Můžeme uvažovat, že ostatní organické funkce jsou odvozeny od uhlovodíků nahrazením jednoho nebo více vodíků atomy nebo skupinami atomů jiných prvků. Obecně platí, že ostatní organické funkce mají kyslík nebo dusík, což jsou více elektronegativní prvky než uhlík. Silněji přitahují dvojici elektronů sdílených s uhlíkem, a proto činí molekulu polární:
Polární připojení:
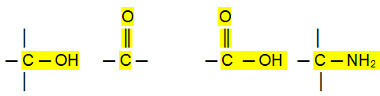
Aldehydy, ketony a organické halogenidy mají vyšší teploty varu než uhlovodíky, protože jejich intermolekulární interakce je permanentní dipól, který je silnější než u indukovaný dipól.
Alkoholy, karboxylové kyseliny a aminy mají naproti tomu ještě vyšší teploty varu, protože provádějí vodíkové vazby, nejintenzivnější typ mezimolekulární interakce.
Ve sloučeninách všech těchto funkcí platí totéž, co jsme viděli u uhlovodíků:

Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/polaridade-temperatura-ebulicao-dos-compostos-organicos.htm

