V textu „Vztah mezi polaritou a rozpustností látek“ jste viděli, že se obecně rozpouští polární látky se rozpouštějí v rozpouštědlech, která jsou také polární, a že nepolární látky se také rozpouštějí v rozpouštědlech nepolární. Toto však není pravidlo, které lze použít pro všechny případy rozpustnosti.
Například cukr se rozpouští ve vodě, ale olej ne. Je pravda, že molekuly vody a cukru jsou polární, zatímco molekuly oleje jsou nepolární, ale jsou to jejich typy mezimolekulární síly mezi molekulami těchto izolovaných látek a navzájem, které nám poskytují vysvětlení skutečnost.

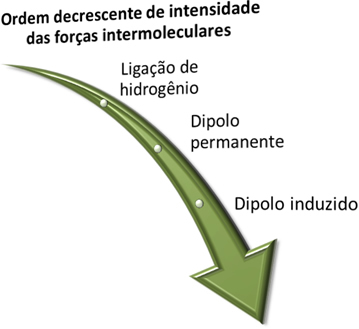
Než uvidíme, jaké jsou tyto síly, pamatujte, že z hlediska intenzity silnější je vodíková vazba, po kterém následuje trvalá dipólová síla a nejslabší je indukovaná dipólová síla.
Molekuly vody i cukru (sacharóza - C12H22Ó11), přítomné atomy kyslíku navázané na atomy vodíku, tvořící skupiny ─ O ─ H. Tohle znamená tamto mezi molekulami vody a mezi molekulami cukru mohou nastat intermolekulární interakce vodíkové vazby.
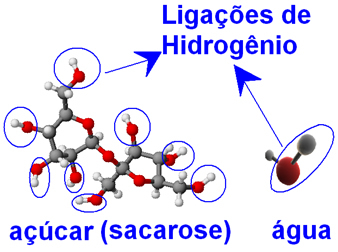
To je důvod, proč jsou molekuly vody schopny zabalit molekuly cukru, které byly pevně spojeny dohromady ve formě krystalů, a odtrhnout je od sebe, což jim brání v opětovném spojení. Cukor má tedy velkou rozpustnost ve vodě a můžeme jej rozpustit až 33 g ve 100 g vody při 20 ° C.
Nyní je ropa a voda nemísitelná. To neznamená, že olej není přitahován k vodě, protože skutečnost, že se rozprostírá po povrchu vody, není ve tvaru sférický, nám odhaluje, že hledá tvar, ve kterém by větší množství molekul oleje bylo v kontaktu s molekulami oleje. Voda.
Nepřestávejte... Po reklamě je toho víc;)
Nicméně, přitažlivost mezi molekulami vody je mnohem větší (vodíková vazba) než přitažlivost mezi molekulami oleje a vody. Molekuly oleje proto nemohou narušit vazbu mezi dvěma sousedními molekulami vody.
To nás vede k závěru, že:
"Pokud je stávající mezimolekulární síla intenzivnější než možná nová interakce, rozpustná látka se nerozpustí, původní vazba zůstane." Pokud je však nová interakce silnější, rozpuštěná látka se rozpustí a rozbije mezimolekulární vazby látek. “
Dalším příkladem, který nám ukazuje důležitost mezimolekulárních sil pro rozpustnost materiálů, je situace, kdy máme jód, vodu a benzen. V níže uvedeném diagramu vidíme, že jód se dobře rozpouští v benzenu a je mírně rozpustný ve vodě, voda a benzen jsou naprosto nemísitelný a když máme směs benzenu a vody a poté přidáme jód, rozpustí se pouze v benzen:
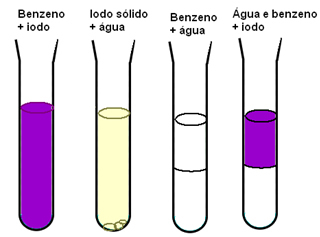
Benzen a jod jsou nepolární a mají snadnější míchání než voda, která je polární. Ale co skutečně vysvětluje, co se stane, je to, že mezimolekulárně indukované dipólové síly existující mezi nepolárními molekulami jsou slabé ve srovnání s vodíkovými vazbami vody.
Proto, protože stávající interakce mezi molekulami vody jsou silnější než možné nové interakce nejsou vodíkové vazby přerušeny a při míchání benzenu a. je pozorován dvoufázový systém Voda.
Nové interakce, které se tvoří mezi molekulami jódu a molekulami benzenu, jsou intenzivnější než ty, které se vyskytují mezi molekulami těchto izolovaných látek.
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Vztah mezi mezimolekulární silou a rozpustností látek“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/relacao-entre-forca-intermolecular-solubilidade-das-substancias.htm. Zpřístupněno 27. června 2021.