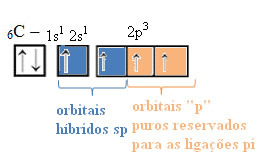
THE uhlíková hybridizace typu sp stane se to pouze tehdy, když vytvoří dvě vazby pí (π) a dvě vazby sigma (σ). V tomto případě tedy existují dvě možnosti: uhlík může vytvořit dvě dvojné vazby nebo jednoduchou a trojnou vazbu, jak je znázorněno níže:
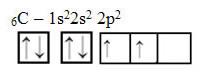
Text "hybridizace typu sp3”Podrobně ukazuje, jak probíhá hybridizace uhlíku. Pamatujeme si: hybridizace je „míchání“ čistých atomových orbitalů, které vznikají navzájem ekvivalentní hybridní atomové orbitaly, ale odlišné od původních čistých orbitalů. To se tedy děje na uhlíkových orbitálech, které byly původně reprezentovány takto:
Avšak s příjmem energie je elektron (představovaný šipkou) z orbitálu 2s povýšen na orbitál 2p:
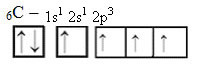
Tímto způsobem má uhlík čtyři nepárové orbitaly, které jsou schopné vytvořit čtyři kovalentní vazby, nejen dvě.
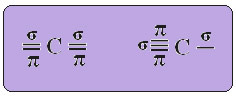
V případě hybridizace typu sp víme, že dvě vazby budou pi; tyto se vyskytují na čistých orbitálech „p“, zatímco další dva orbitaly, které jsou sp hybridy, vytvoří zbývající sigma vazby.
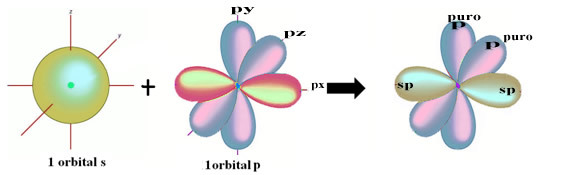
Prostorové znázornění této hybridizace mezi s a p orbitálem, které vedlo ke vzniku hybridního sp orbitálu, lze vyjádřit následovně:
Nepřestávejte... Po reklamě je toho víc;)
Na obrázku výše je zcela jasné, že existují dva čisté orbitaly, které vytvoří vazby pí.
Abychom pochopili, jak se to děje, vezměme si jako příklad molekulu kyanidového plynu (HCN) používanou ve Spojených státech v plynových komorách pro vězně odsouzené k trestu smrti. Jeho strukturní vzorec je dán vztahem:
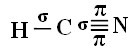
Pokud jde o uhlík, jeho atomové orbitaly již byly ukázány, nyní se podívejte na vodíkové a dusíkové orbitaly:
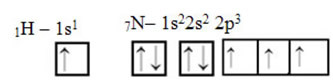
Všimněte si, že nepárový vodíkový orbitál, který bude provádět sigma vazbu, je „s“, které je prostorově reprezentováno kruhem; a dusíkové orbitaly jsou typu „p“, představované třemi dvojitými vejcovinami (každý v prostorovém poli: x, y, z). Struktura molekuly HCN je tedy znázorněna následovně:
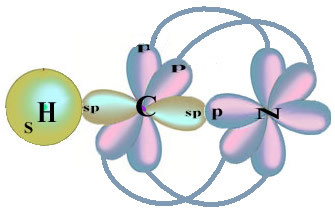
Pokud jde o typ vazeb existujících v této struktuře formaldehydu, máme:
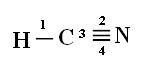
Připojení: 1 = σs-sp
2 = σp-sp
3 = 4 = πp-p
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Hybridizace typu Sp“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm. Zpřístupněno 28. června 2021.