
Někdy se to může stát minimální vzorec být stejný jako molekulární vzorec sloučeniny; to však není vždy pravda.
Například empirický nebo minimální vzorec pro vodu je H2O, což naznačuje, že mezi prvky, které tvoří molekuly vody, je poměr 2: 1. A shodou okolností je to také molekulární vzorec pro vodu. Chcete-li však vidět, že k tomu nedochází vždy, podívejte se na dva níže uvedené příklady:
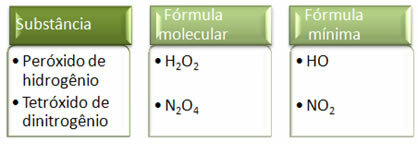
Protože minimální vzorec je pouze poměr atomů každého prvku a nikoli jejich skutečné množství v molekulárním vzorci, může nastat různých sloučenin majících stejný empirický vzorec a dokonce i minimální vzorec sloučeniny může být stejný jako molekulární vzorec sloučeniny jiný. V níže uvedeném příkladu si všimněte, jak k tomu může dojít:
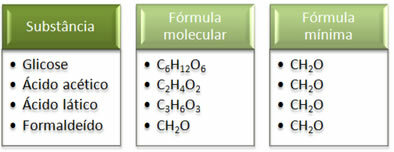
Podívejte se, že minimální vzorec CH2To je stejné pro všechny látky, to znamená, že tento minimální vzorec vyjadřuje, že ve všech případech je atomy uhlíku, vodíku a kyslíku jsou přítomny v molekulárních vzorcích v poměru 1:2:1. Jediným, kdo má stejný molekulární vzorec jako empirický vzorec, je navíc formaldehyd.
- Výpočet minimálního nebo empirického vzorce:
K určení empirického vzorce sloučeniny je nejprve nutné vědět, jaké je její procento nebo bližší vzorec. Toho lze dosáhnout měřením hmotnosti každého prvku ve 100 g vzorku. Text "Procentní nebo centimální vzorec“Objasňuje tuto záležitost lépe.
Nepřestávejte... Po reklamě je toho víc;)
Řekněme například, že nejbližší složení dané sloučeniny je dáno vztahem: 40,00% C, 6,67% H a 53,33% O. Tyto hodnoty předáme gramům s ohledem na hmotnost 100 g složeného vzorku. Máme tedy: 40 g C, 6,67 g H a 53,33 g O.
Nyní je nutné předat tyto hodnoty množství hmoty (mol). Děláme to dělením každé z nalezených hodnot jejich příslušnými molárními hmotnostmi:
C: 40/12 = 3,33
H: 6,67 / 1 = 6,67
O: 53,33 / 16 = 3,33
Protože hodnoty nejsou celá čísla, použijeme následující zařízení: vydělíme všechny hodnoty nejmenší z nich, aby se poměr mezi nimi nezměnil.
V tomto případě je nejmenší hodnota 3,33, takže výsledek bude:
C: 3,33 / 3,33 = 1
H: 6,67 / 3,33 = 2
O: 3,33 / 3,33 = 1
Minimální vzorec této neznámé látky se tedy rovná: C1H2Ó1 nebo CH2Ó.
Stručně řečeno, kroky potřebné k nalezení empirického nebo minimálního vzorce látky jsou:

Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. "Minimální nebo empirický vzorec"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm. Zpřístupněno 28. června 2021.


