* Teorie Arrhenius:
Na základě jeho experimentů s elektrickou vodivostí ve vodném prostředí, chemickými, fyzikálními a matematickými Švédský Svante August Arrhenius (1859-1927) navrhl v roce 1884 následující pojmy pro definici kyselin a základy:

Obecně tedy máme:
H+ + H2O → H3Ó+
Příklady:
HCl + H2O → H3Ó++ Cl-
HNO3+ H2O → H3Ó+ + NE3-
H2POUZE4+ 2 hodiny2O → 2H3Ó+ + OS42-

Příklady:
NaOH → Na + + OH-
Ca (OH)2 → Ca2+ + 2 OH-
* Brönsted-Lowryova teorie:
Nezávisle na tom je Dán Johannes Nicolaus Brönsted (1879-1947) a Angličan Thomas Martin Lowry (1874-1936), navrhl ve stejném roce další acidobazickou teorii známou jako Brönsted-Lowryova teorie, která říká Následující:

V tomto případě je vodíkový iont považován za proton. To je vidět na následující reakci, kdy kyselina kyanovodíková daruje proton vodě, která proto působí jako báze:
HCN + H2O → CN- + H3Ó+
Tato reakce je reverzibilní s hydroniovým iontem (H3Ó+) může darovat proton iontu CN-. Hydroniový iont (H3Ó+) působí jako kyselina a CN- jako základna.
CN- + H3Ó+→ HCN + H2Ó
* Lewisova teorie:
Tuto teorii vytvořil americký chemik Gilbert Newton Lewis (1875-1946) a uvádí následující:

Nepřestávejte... Po reklamě je toho víc;)
Tato teorie zavádí nový koncept, je komplexnější, ale nevyvrací platnost teorie Brönsted-Lowry. Pro každou Lewisovu kyselinu je Brönstedova kyselina, a proto je každá Lewisova báze Brönstedovou bází. Je to proto, že proton přijímá elektrony, což znamená, že se Lewisova kyselina může připojit k osamocenému páru elektronů v Lewisově bázi.
U Lewise spočívá acidobazická reakce ve vytvoření stabilnější koordinované kovalentní vazby. Takže když Lewisova báze daruje pár elektronů na Lewisovu bázi, oba tvoří a souřadnicová kovalentní vazba, ve které oba elektrony pocházejí z jednoho z atomů, jako v příkladu níže:
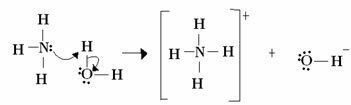
V tomto případě amoniak působí jako Lewisova a Brönstedova báze, protože daruje své dva elektrony protonu, a je tedy přijímačem protonu. Kromě toho byla vytvořena kovalentní vazba mezi vodíkem (proton) a amoniakem.
Voda je Lewisova kyselina a Brönstedova kyselina, protože daruje proton a přijímá elektrony, všimněte si, jak kyslík v hydroxidu vytvořeném z vody má další pár elektronů.

Autor: Jennifer Fogaça
Vystudoval chemii
Tým brazilské školy.
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Arrhenius, Brönsted-Lowry a Lewisova acidobazická teorie“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm. Zpřístupněno 28. června 2021.