Existují tři typy alkadienů nebo dienů, které jsou:
1 akumulované: Dvojné vazby jsou umístěny na stejném uhlíku a objevují se postupně:
─C ═ C ═ C ─
│ │
2 Izolované: Dvojné vazby jsou na různých uhlících a jsou odděleny nejméně dvěma po sobě následujícími jednoduchými vazbami:
│
─C ═ C C ─ C ═ C ─
│ │ │ │ │
3 - Konjugáty: Dvojité vazby se objevují střídavě a jsou odděleny jedinou jednoduchou vazbou:
─C ═ C C ═ C ─
│ │ │ │
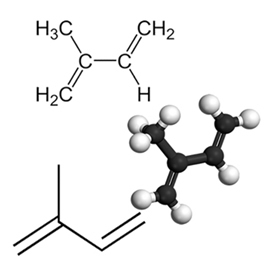
Příkladem důležitého konjugovaného dienu je izopren, který je základní jednotkou terpenové skupiny, třídy organických sloučenin. velmi důležité, některé příklady produktů vytvořených izopreny jsou guma, beta-karoten (zodpovědný za oranžovou barvu produktu) mrkev), vitamin A a oleje z ovocných slupek, semen, květů, listů, kořenů, zeleniny a dřeva, jako je limonen a myrcen.
Do nahromadění a izolovaní dienové, dochází k adičním reakcím stejně jako v případě alkenů, čemu porozumíte čtením textu Reakce sčítání. Jediný rozdíl je v tom, že tento druh dvojité reakce podstupují dienové, protože mají dvě dvojné vazby, zatímco alkeny mají pouze jednu dvojnou vazbu.
V případě konjugované dieny, adiční reakce má určitou zvláštnost, protože tyto sloučeniny mohou podléhat rezonanci, takže adice může probíhat dvěma způsoby:
1 - Dodatek 1.2:
Toto je považováno za normální adici, protože adice nastává na dvou atomech uhlíku, které tvoří stejnou dvojnou vazbu, tj. Na uhlících 1 a 2:
Nepřestávejte... Po reklamě je toho víc;)
H2C ═ CH─ CH ═ CH2 + HBr → H2C CH─ CH ═ CH2
│ │
HBr
Podívejte se, že tento typ reakce následuje Markovnikovovo pravidlo, vodíkové vazby na více hydrogenovaný uhlík (s připojeným více atomy vodíku).
Přídavek 1,2 se zpracovává při nízkých teplotách (-60 ° C).
2- Dodatek 1.4:
V tomto případě reakce probíhá při vysokých teplotách. Je důležité zdůraznit, že se vždy tvoří produkt přídavku 1,2 i přídavek 1,4, ale teplota naznačuje, které se budou tvořit ve větším množství.
Následuje příklad přidání typu 1.4:
H2C ═ CH─ CH ═ CH2 + HBr → H2C CH ═ CH─CH2
│ │
HBr
Všimněte si, že dojde k následujícímu, jednomu ze sdílených elektronů ve vazbě pí každého z dvojných uhlíků jsou sdíleny se substituentem a ostatní tvoří novou dvojnou vazbu mezi jinými uhlíky:
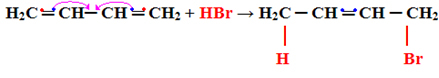
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. "Adiční reakce v Dienes"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/reacoes-adicao-dienos.htm. Zpřístupněno 28. června 2021.