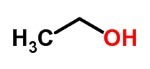
Na chemické vzorce jsou vyjádření používaná k označení, které chemické prvky jsou součástí složení látky, a také k vyjádření typu interakce mezi zúčastněnými atomy.
Prostřednictvím analýzy vzorec chemické látky, můžeme určit povahu chemických vazeb (iontový, kovalentní nebo kovové), které jej formovaly, stejně jako jeho fyzikálně-chemické chování. Některé z vlastností, které souvisejí s fyzikálně-chemickým chováním látky, jsou:
Rozpustnost
Fúzní bod
Bod varu
Reaktivita
Nyní znáte typy sloučenin, které tvoří chemikálie, a také vzorce, které je představují.
Druhy sloučenin
The) iontové sloučeniny
Iontové sloučeniny jsou všechny chemické látky tvořené iontovou vazbou mezi atomy, to znamená, že v těchto sloučeninách existují atomy, které ztrácejí, a atomy, které získávají elektrony. Kombinace chemických prvků, které tvoří tento typ sloučeniny, může být:
Kov s ametalem
Kov s vodíkem
b) Kovalentní sloučeniny
Kovalentní sloučeniny jsou všechny chemické látky vytvořené kovalentní vazbou mezi atomy, to znamená, že v těchto sloučeninách existují atomy, které navzájem sdílejí elektrony. Kombinace chemických prvků, které tvoří tento typ sloučeniny, může být:
ametal na ametal
Ametal s vodíkem
vodík s vodíkem
c) Sloučeniny kovů
Sloučeniny kovů jsou všechny chemické látky tvořené atomy jediného kovového prvku. V těchto sloučeninách atomy sdílejí pouze elektrony navzájem.
Vzorce pro iontové sloučeniny
The) iontový vzorec
Ion vzorce udává počet atomů, které tvoří iontovou jednotku sloučeniny, jako v případě chloridu sodíku, jehož iontem vzorce je NaCl. Ve vzorci identifikujeme přítomnost atomu sodíku a atomu chlór.
Chcete-li vytvořit iontový vzorec, stačí překročit náboje každého z iontů, které tvoří iontovou sloučeninu. Pro Al kation+3 a anion O-2například když překročíme náboje a ignorujeme signály, máme následující vzorec iontu:

b) Elektronický vzorec
Elektronický vzorec se používá k vyjádření ztráty a zisku elektronů atomů podílejících se na tvorbě sloučeniny. Kolem zkratky každého prvku máme každý z elektronů valenční vrstvy.
V případě chloridu sodného (NaCl) máme v Na zastoupen pouze jeden valenční elektron (protože je z rodiny IA) a v Cl máme sedm valenčních elektronů (protože je z rodiny VIIA).

NaCl elektronický vzorec
Zisk elektronu Cl (nekovový) a ztrátu elektronu Na (nekovový) jsou znázorněny šipkou. Podle teorie oktetů„Na ztratí elektron, protože má jen jeden, a Cl získá jeden, aby dokončil osm valenčních elektronů.
Nepřestávejte... Po reklamě je toho víc;)
Pro kovalentní sloučeniny
a) Molekulární vzorec
Molekulární vzorec slouží ve zjednodušené formě k kovalentní látce. Molekulární vzorec vody, který je H2Například O má dva atomy vodíku a jeden atom kyslíku.
Na rozdíl od iontového vzorce iontových sloučenin není molekulární vzorec kovalentní sloučeniny tolik vytvořen jednoduchost, protože různá množství atomů stejných prvků tvoří různé látky, jako je voda (H2O) a peroxid vodíku (H2Ó2).
Na cvičeních je velmi běžný molekulární vzorec:
Být zajištěno samotným cvičením;
Být určen výpočtem;
Určete počítáním každého prvku ze strukturního vzorce;
Určete podle názvu látky.
b) Strukturní vzorec
Strukturní vzorec kovalentní látky se používá k vyjádření počtu vazeb, které každý z atomů tvoří v molekule. Odkazy, které se používají ve strukturním vzorci, jsou:
Jeden odkaz: reprezentovaný pomlčkou (─), označuje jeden odkaz;
Dvojitá vazba: reprezentovaná dvěma pomlčkami (=), označuje dvě vazby;
Trojitá vazba: reprezentovaná třemi pomlčkami (≡), označuje tři vazby;
dativní odkaz: představované šipkou (→), označuje jedno připojení.
Strukturní vzorec kovalentních sloučenin by měl být reprezentován, kdykoli je to možné, podle molekulární geometrie dané molekuly. Podívejte se na znázornění strukturního vzorce amoniaku, který má pyramidovou geometrii:

c) Elektronický vzorec
Elektronický vzorec pro kovalentní sloučeninu ukazuje sdílení elektronů mezi atomy, které tvoří molekulu. Místo pomlček použitých ve strukturním vzorci máme k reprezentaci elektronů sdílených mezi atomy použití koulí. Dívej se:
Jednoduchá vazba: sdílení dvou elektronů (jeden z každého ze zúčastněných atomů);
Dvojná vazba: sdílení čtyř elektronů (dva z každého ze zúčastněných atomů);
Trojná vazba: sdílení šesti elektronů (tři z každého ze zúčastněných atomů);
Datová vazba: sdílení dvou elektronů (oba jsou z jednoho atomu mezi zúčastněnými),
U amoniaku, jehož strukturní vzorec byl uveden výše, je tedy jeho elektronový vzorec:

Pro kovové sloučeniny
Sloučeniny kovů, protože jsou tvořeny výlučně atomy jednoho kovu, mají jako chemický vzorec zkratku chemického prvku:
Měděná látka: Cu
Zlatá látka: Au
Železná látka: Fe
Podle mě. Diogo Lopes Dias
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
DNY, Diogo Lopes. „Vzorce chemických látek“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/formulas-substancias-quimicas.htm. Zpřístupněno 27. června 2021.