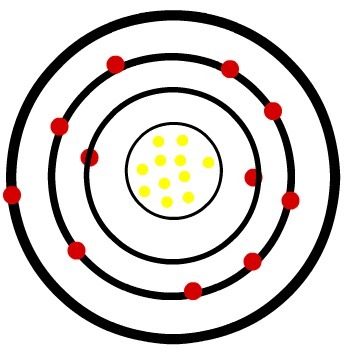
Radioaktivita je vlastnost, kterou mají některé atomy rádi uran a rádio, muset vydat spontánně energie ve tvaru částice a mávat, stává se chemické prvky stabilnější a lehčí.
Typy
Radioaktivita se projevuje dvě cesty různé záření: částice - alfa (α) a beta (β); a elektromagnetická vlna - gama paprsky (γ).
alfa paprsky: jsou to pozitivní částice složené ze dvou protonů a dvou neutronů a s nízkou penetrační silou.
paprsky beta: jsou negativní částice, které neobsahují hmotu sestávající z elektronu (zanedbatelná hmotnost) a jejich penetrační síla je větší než u paprsků alfa, ale menší než u paprsků gama.
Gama: jsou to vysokoenergetické elektromagnetické vlny a protože to nejsou částice, nemají ani hmotnost.
Přečtěte si také: Vzorce radioaktivity
Nepřestávejte... Po reklamě je toho víc;)
zákony
Radioaktivní emise částic sleduje určitá chování, která jsou vysvětlena zákony radioaktivita (jedna pro částice alfa a druhá pro částice beta), které popsal chemik Angličtina Frederick Soddya polským chemikem a fyzikem Kazimierz Fajans.
První zákon radioaktivity
Podle tohoto zákona, když radioaktivní atom vyzařuje záření alfa typu, vznikne a nový atom s jádrem obsahujícím dva protony a dva neutrony méně, celková hmotnost o čtyři jednotky menší. První zákon radioaktivity můžeme představit následující obecnou rovnicí:
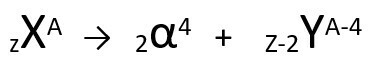
Obecná rovnice prvního zákona radioaktivity.
Podívejme se na příklad:
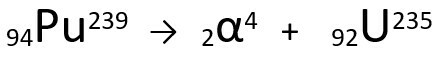
Rovnice představující emise α-částic Plutoniem-239.
Všimněte si, že při vyzařování alfa záření má nově vytvořený atom Uran-235 hmotnostní číslo o čtyři jednotky menší a atomové číslo o dvě jednotky menší - přesně ty hodnoty, které odpovídají částice α emitované jádrem plutonium. Další informace o: První zákon o radioaktivitě nebo první zákon o Soddy.
Druhý zákon radioaktivity
Druhý zákon hovoří o beta vydání. Když atom emituje beta částici, skládající se z elektronu a zanedbatelné hmotnosti, její atomová hmotnost Zůstává beze změny je to tvoje atomové číslo zvyšuje jednu jednotku. Obecně zastupujeme takto:
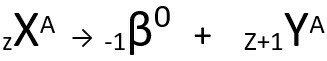
Obecná rovnice druhého zákona radioaktivity.
Viz příklad:
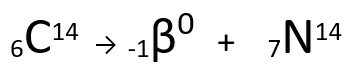
Rovnice představující emise β-částic uhlíkem-14.
Je vidět, že vytvořený atom dusíku má stejnou hmotnost jako atom C-14, to znamená, že jsou isobarya jeho atomové číslo se zvyšuje o jednu jednotku. Nárůst v protonové číslovysvětlil vědec Henrico Fermi, který navrhl, aby jeden z neutrony jádra podstoupí transmutaci, podle následující rovnice, generující Aelektron(emitovaná beta částice), A neutrino(subatomární částice bez elektrického náboje a bez hmotnosti) a A proton(P).
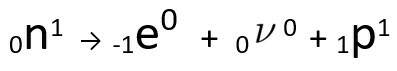
Rovnice představující neutronovou transmutaci, podle Fermiho hypotézy.
Ó elektron to je neutrino jsou vydávány z jádra, zbývající pouze proton, což vysvětluje nárůst atomového čísla. Chcete-li se o něm dozvědět více, přejděte na: Druhý zákon radioaktivity nebo druhý zákon soddy.
Přečtěte si také: Rozdíl mezi radioaktivní kontaminací a ozářením
aplikace
navzdory negativní pohled ten vklad na radioaktivitu má důležité aplikace v našem každodenním životě, například v produkce elektřinav jaderné elektrárny přes štěpeníradioaktivních atomů.
V současné době Brazílie nepoužívá nukleární energie jako hlavní zdroj energie, ale má jaderné elektrárny (Angra 1 a 2), které dodávají elektřinu do země. Můžeme také zmínit datování materiálu našel archeologové pomocí uhlík-14.

Jaderná elektrárna Rio de Janeiro, Brazílie
Další zásadní role, kterou hraje radioaktivita, souvisí s oblastí medicíny, například v Rentgena v CT, a také u některých typů léčba rakoviny.
Přečtěte si také: Hlavní rizika výroby jaderné energie pro životní prostředí
přírodní radioaktivita
denně jsme vystavena The malé množství záření, ať už umělého nebo přírodního. Přirozená radioaktivita se v přírodě vyskytuje spontánně. Část tohoto záření, které dostáváme, pochází z potravin konzumovaných denně, jako jsou radon-226 a draslík-40, které jsou prezentovány v velmi nízké úrovně a nepředstavují riziko pro naše zdraví ani nepoškozují nutriční hodnoty potravin.
Tento proces vystavení potravin radioaktivním emisím je zamýšlen konzervovat jídlo a propagovat růst rostlin. Některé příklady potravin, které emitují záření, jsou: brazilské ořechy, banán, fazole, červené maso, mezi ostatními.
Objev
Studium radioaktivity začalo výzkumem německého fyzika Wilhelm Röentgen, v roce 1895, když vyšetřoval účineksvětélkování. Dalším důležitým vědcem pro vývoj radioaktivity byl francouzský fyzik Antoine-Henri Becquerel, který si v roce 1896 všiml značek provedených na fotografickém filmu vzorkem uranové soli.
Bylo to však Curie pár kdo poprvé použil pojem radioaktivita. v 1898, polský Marie Curie pokračovaly ve studiích radioaktivity a provedly cenné objevy pro tuto oblast, například objev dvou nových radioaktivních prvků: polonia (Po) a radia (Ra).
Dozadu, Ernest Rutherford objevil záření alfa typu (α) a beta (β), který umožnil lepší vysvětlení jeho atomového modelu, stejně jako pokrok ve výzkumu souvisejícím s radioaktivitou.
Přečtěte si také:Marie Curie: biografie, příspěvky a dědictví
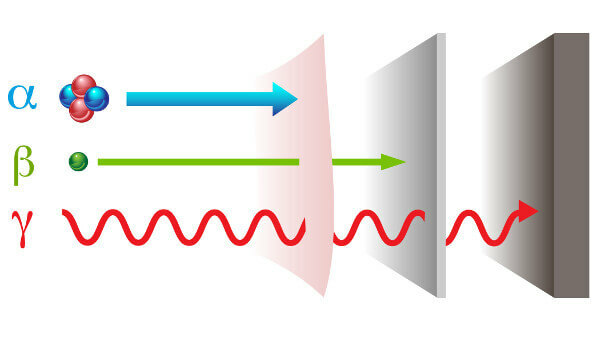
Druhy záření a jejich penetrační schopnosti.
rozklad
Ó radioaktivní rozpad (nebo transmutace) je přirozený proces kde jeden nestabilní jádro vyzařuje záření, postupně, v následujících situacích snížit energii a stát se stabilním.
K tomu obvykle dochází u atomových čísel atomů. větší než 84, což jsou atomy s vysoká nestabilita nukleární kvůli množství kladného náboje (protonů) akumulovaného v jádru. V tomto procesu je neutrony nestačí stabilizovat všechny protony seskupené v jádře a poté začne jádro radioaktivní rozpad, dokud jeho atomové číslo nebude menší než 84.
V některých případech se může stát, že atomy s atomovým číslem menším než 84 mají nestabilní jádra a také projít procesem rozpadu, ale k tomu musí mít počet protonů značně vyšší než počet neutrony.
Radioaktivní rozpad je vypočteno poločasem (nebo období polorozpadu, P) radioizotop, což je čas potřebný k tomu, aby se polovina hmotnosti původního radioaktivního vzorku rozpadla, tj. aby se stala stabilní. Graficky řečeno, koncept poločasu je znázorněn níže. Protože to je kontinuální proces, křivka má tendenci dosáhnout nula.
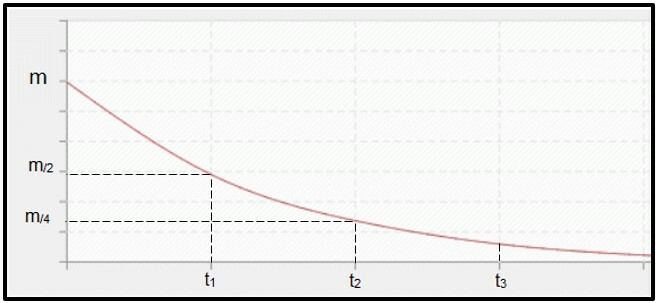
Graf představující poločas rozpadu.
Výpočty zahrnující radioaktivní rozpad se řídí následujícími vzorci:
Vzorec pro výpočet zbývající hmotnosti po poločasu rozpadu:
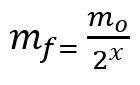
mF - závěrečná mše
mÓ - počáteční hmotnost
x - množství uplynulých poločasů
Vzorec pro výpočet doby rozpadu radioaktivního vzorku:
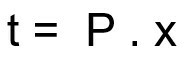
t - doba rozpadu
P - poločas rozpadu
x - množství uplynulých poločasů
radioaktivní prvky
Existují dva typy radioaktivní prvky: vy přírodní a umělý. Přirozené mají prvky nalezené v přírodě, již s jejich nestabilními jádry, jako například uran, O aktinium to je rádio. Umělé jsou vyráběny procesy, které destabilizují jádro atomu. V tomto případě můžeme zmínit astat to je francium.
Hlavními radioaktivními prvky jsou: uran-235, kobalt-60, stroncium-90, radium-224 a jód-131. Vzhledem k širokému použití v jaderných elektrárnách a při léčbě rakoviny se tyto prvky obvykle objevují častěji v našem každodenním životě. Další informace o tomto tématu najdete na adrese: radioaktivní prvky.
Radioaktivní odpad
Radioaktivní odpad nebo jaderný odpad to je zbytek z průmyslová odvětví kteří ve svých procesech používají radioaktivní materiál, který již nemá praktické využití. Tento odpad pochází hlavně z jaderné elektrárny je to z lékařské aplikace.
Velká produkce radioaktivního odpadu byla a problém životního prostředí pro celý svět, kvůli nedostatku a nedostatečnosti podmínky likvidace a skladování.
Tato hlušina je spojena s kontaminací půdy, vodních toků a vzduchu, což má za následek ničení životního prostředí postupně. Kromě toho také představují rizika pro lidské zdraví, jako např infekce, rakovina a v závažnějších případech kontaminace mohou vést k smrt.
vyřešená cvičení
(PUC-Camp-SP) Atomová bomba, nazývaná také jaderná bomba, má jako štěpnou složku atomy uranu 235, , emitory částic alfa
, emitory částic alfa  . Každý atom U-235 je při emitování částice alfa transformován na jiný prvek, jehož atomové číslo se rovná
. Každý atom U-235 je při emitování částice alfa transformován na jiný prvek, jehož atomové číslo se rovná
a) 231.
b) 233.
c) 234.
d) 88.
e) 90.
Šablona: Když atom emituje alfa částici, dochází podle prvního zákona o radioaktivitě k poklesu atomového čísla o dvě jednotky. Proto: 92-2 = 90. Písmeno e.
(PUC-Camp-SP) Jód-125, radioaktivní odrůda jódu s léčivými aplikacemi, má poločas 60 dnů. Kolik gramů jódu-125 zůstane po šesti měsících, na základě vzorku obsahujícího 2,00 g radioizotopu?
a) 1,50
b) 0,75
c) 0,66
d) 0,25
e) 0,10
Šablona: Nejprve se vypočítá počet biologických poločasů uplynulých během 180 dnů:
t = P. X
180 = 60. X
x = 3
Jakmile se najde počet uplynulých poločasů, vypočítá se hmotnost, která zůstane na konci 180 dnů:
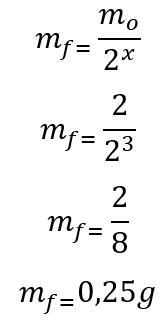
Proto 0,25 g radioizotopu jodu-135 zůstane na konci šesti měsíců. Písmeno D.
Victor Felix
Vystudoval chemii