Ó teplo je to tepelná energie, která přechází z těla s vyšší teplotou do jiného s nižší teplotou. Pokud mezi dvěma tělesy není žádný rozdíl v teplotě, nedochází k žádnému teplu.
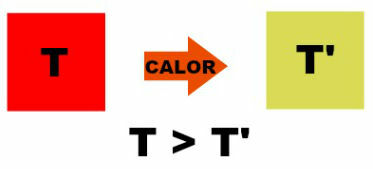
Obrázek výše ukazuje přechod tepla z tělesa s teplotou T do jiného tělesa s nižší teplotou odpovídající T '. Když se tělesné teploty vyrovnají, říkáme, že tepelná bilance bylo dosaženo a v tu chvíli, protože nedojde k žádnému teplotnímu rozdílu, přestane teplo proudit.
Zde je několik důležitých bodů týkajících se tepla:
1) KALORICKÉ: Až do začátku 19. století se věřilo, že teplo souviselo s přítomností tzv. Neviditelné a beztížné tekutiny kalorický. Čím vyšší je teplota těla, tím větší je množství této látky v jeho nitru. Na základě pozorování Benjamina Thompsona, známého jako hrabě z Rumfordu (1753-1814), byly provedeny experimenty, které prokázaly myšlenku, že teplo je energie. Experiment s největším významem v tomto důkazu patří Prescottovi Jouleovi (1818-1889).
Mind Map: Heat
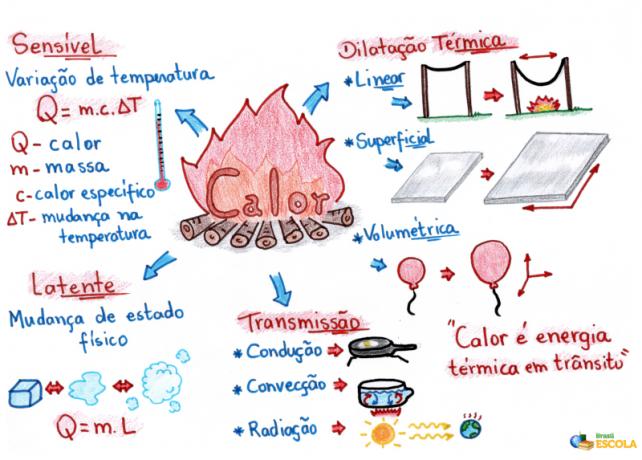
* Chcete-li stáhnout myšlenkovou mapu v PDF, Klikněte zde!
2) Měrná jednotka: Podle Mezinárodní systém jednotek (SI), měrná jednotka tepla je joule, ale hodně se používá jednotka kalorií (cal).
1 kal = 4,18 J
Kalorie je množství tepla potřebné ke zvýšení teploty 1 g vody o 1 ° C.
3) Zdroje tepla:Jakýkoli prvek schopný vyvolat zvýšení teploty v jiném tělese je zdrojem tepla. Jako příklad můžeme uvést plamen kamen, pece, krbu atd.
4) Přenos tepla: Existují tři možné způsoby přenos tepla:
- Řízení: Když teplo přechází z molekuly na molekulu materiálu;
- Proudění: Přenos tepla v tekutině, ke kterému dochází v důsledku hromadného přemístění samotné tekutiny;
-
Záření: Přenos tepla elektromagnetickými vlnami.
5) Druhy tepla: Když dodáte množství tepla schopné pouze generovat teplotní změny v těle, toto množství energie se nazývá citelné horko. Když množství přenášeného tepla způsobí změnu fyzického stavu, je to nazýváno latentní teplo.
Joab Silas
Vystudoval fyziku
* Mental Map by Me. Rafael Helerbrock
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-calor.htm