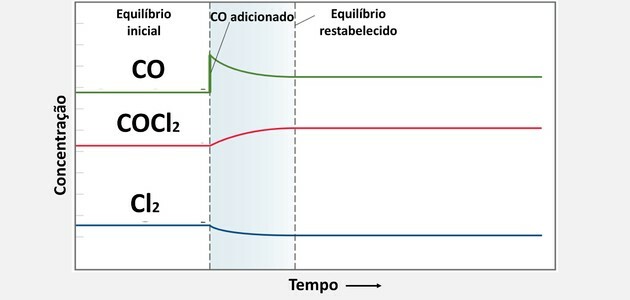
Reverzibilní reakce obvykle začínají určitým množstvím činidel. Jak začíná přímá reakce, tato činidla se časem spotřebují na tvorbu produktů, následně klesá koncentrace činidel, zatímco koncentrace produktů zvyšuje. Poté také začne inverzní reakce, která produkuje také reaktanty, dokud rychlost vývoje (rychlosti) přímé a inverzní reakce nezůstane stejná a dosáhne tzv. chemická rovnováha.
V rovnováze existuje rovnovážná konstanta Kc, která je v zásadě vyjádřena:
|
Kc = [produkty]koeficient ve vyvážené chemické rovnici [činidla]koeficient ve vyvážené chemické rovnici |
To znamená, vezmeme-li v úvahu následující generickou rovnovážnou reakci:
a A + b B ↔ c C + d D
Jelikož malá písmena jsou koeficienty a velká písmena látky, bude rovnovážná konstanta této reakce:
Kc = [C]C. [D]d
[THE]The. [B]B
Více podrobností najdete v textu Rovnovážné konstanty Kc a Kp. Tento text nám také ukazuje něco důležitého: že hodnoty Kc nám mohou ukázat, zda je koncentrace činidel a produkty jsou stejné nebo je-li jeden větší než druhý, a v důsledku toho, pokud je chemická rovnováha posunuta v určitém směru reakce.
Musíme tedy určit hodnotu Kc. Chcete-li to provést, mějte na paměti, že tyto výpočty jsou experimentální, takže se podívejme na některé příklady reakcí a data z nich získaná.
Při provádění těchto výpočtů je velmi užitečné napsat tabulku podobnou té, která je uvedena níže, a postupovat podle kroků v ní uvedených:

Tabulka pro uspořádání dat použitých k výpočtu rovnovážné konstanty
Nyní pojďme procvičovat:
Příklad 1: V uzavřené nádobě o objemu 2 litry při teplotě 100 ° C je 20 mol dusíku2Ó4. Začíná docházet k následující reverzibilní reakci: N2Ó4 ↔ Č2. Po nějaké době bylo zjištěno, že reakce dosáhla chemické rovnováhy a že 8 mol NO2 se vytvořila. Jaká je hodnota rovnovážné konstanty Kc při teplotě 100 ° C?
Nepřestávejte... Po reklamě je toho víc;)
Řešení:
Použijme tabulku:

Tabulka použitá k řešení příkladu výpočtu rovnovážné konstanty
Všimněte si, že v řádku, kde byly zapsány veličiny, které reagují a tvoří se, víme, že byly utraceny 4 moly N2Ó4, protože poměr je 1: 2, a že vzniklo 8 mol NO2.
Nyní stačí nahradit hodnoty nalezené ve vyjádření rovnovážné konstanty Kc této reakce:
Kc = [NA2]2
[N2Ó4]
Kc = (4 mol / l) 2
(8 mol / l)
Kc = 2 mol / l
Hodnota Kc je bezrozměrná, nemá žádnou jednotku související s jakoukoli velikostí.
Podívejme se nyní na příklad, který od začátku také obsahuje produkty:
Příklad 2: V uzavřené nádobě o objemu 5 litrů jsou při teplotě T 2 moly plynného vodíku, 3 moly plynného jódu a 4 moly jodovodíku. Reakce vstupuje do chemické rovnováhy při teplotě T a ukázalo se, že v nádobě je 1 mol plynného vodíku. Jaký je graf představující tuto rovnováhu a jaká je hodnota rovnovážné konstanty Kc při teplotě T?
Řešení:
Použití tabulky:
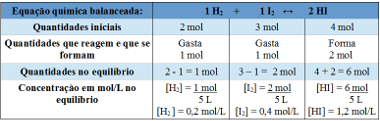
Tabulka použitá ke stanovení rovnovážné konstanty
Graf znázorňující změny v koncentracích mol / L činidel a produktů, dokud nedosáhnou rovnováhy, může být dán vztahem:

Graf chemické rovnováhy ukazující změny v koncentracích činidel a produktů
Nyní objevíme hodnotu rovnovážné konstanty:
Kc = __ [HI]2__
[H2 ]. [Já2]
Kc = (1,2)2
0,2. 0,4
Kc = 18
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. "Výpočet rovnovážné konstanty Kc"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm. Zpřístupněno 28. června 2021.
Chemie

Otestujte si své znalosti a dozvíte se více s tímto seznamem řešených cvičení o chemických bilancích. Prostřednictvím tohoto materiálu budete schopni lépe porozumět tomu, jak pracovat s rovnovážnými konstantami (Kp, Kc a Ki), rovnovážným posunem, pH a pOH a také s rovnováhou v takzvaných pufrovacích roztocích.